
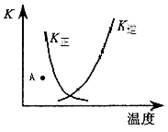
| A.正反应为吸热反应 |
| B.升高温度,有利于反应向正方向进行 |
| C.A点时,反应向逆反应方向移动 |
| D.K正与K逆的关系是:K正=1/K逆 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.粉末状态的煤比块状煤的着火点低 |
| B.粉末状态的煤比块状煤放出的热量多 |
| C.粉末状态的煤比块状煤的总表面积大 |
| D.粉末状态的煤呈气态,属于可燃性气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+3D(g) ΔH<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
C(g)+3D(g) ΔH<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
| A.图Ⅰ可体现t0时升高温度对反应速率的影响 |
| B.图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度不变时,增大反应物浓度可能增大活化分子的分子数 |
| B.其他条件不变时,升高温度能使分子获得更高的能量,活化分子百分数提高 |
| C.其他条件不变时,对于有气体参与和生成的反应而言,增大体系的压强能增大单位体积内的活化分子百分数 |
| D.其他条件不变时,加人正催化剂能提高反应体系中含有的活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向FeCl3和KSCN混合溶液中加入少量KCl固体,溶液血红色变浅 |
| B.向5mL 0.1mol/L K2Cr2O7溶液中加入少量NaOH固体,溶液由橙色变为黄色 |
| C.等体积等浓度Na2S2O3和H2SO4混合,温度升高出现浑浊和生成气体速度加快 |
| D.酸性KMnO4溶液中滴加H2C2O4,H2C2O4浓度越大褪色和生成气体速度越快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3COONa固体 | B.NaOH溶液 | C.(NH4)2 SO4粉末 | D.K2 SO4固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是| A.充入氦气 | B.分离除乙醇 | C.增大压强 | D.升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com