
| ||
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 充电 |
| 放电 |
| ||
| 高温高压 |
| 时间/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O;ΔH=-483.6 kJ·mol-1
2H2O;ΔH=-483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的ΔH=________。
2NH3(g)的ΔH=________。
(2)工业上在一定温度下,将一定量的N2和H2通入到体积为
①增大压强②增大反应物的浓度③使用催化剂④降低温度
(3)当化学反应N2(g)+2H2(g) ![]() 2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将
2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将

(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:

①请写出氢氧燃料电池中的电极反应式:
负极:____________________________________________________________;
正极:____________________________________________________________。
②上图装置中,某一铜电极的质量减轻了
查看答案和解析>>
科目:高中化学 来源:2014届北京市高三上学期第一次月考化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
(3)已知:
①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)?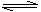 ?2NH3(g) ΔH2=-92.4 kJ·mol-1
?2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
氨的催化氧化反应的热化学方程式为
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省潍坊市寿光市高三(上)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com