
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
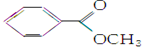 是一种重要的工业用有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
是一种重要的工业用有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.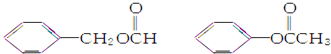
| 丙的分子式 | C7H8O |
| 丙的部分性质 | 熔融状态下能与钠反应放出氢气 |
| 与乙酸能发生酯化反应 |
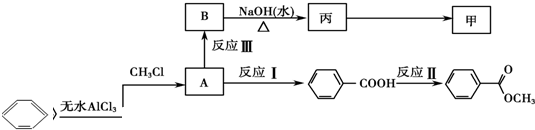
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与烧碱溶液反应:Cl2+2OH-=H2O+Cl-+ClO- |
| B、氯气与KOH溶液反应:Cl2+2OH-=H2O+Cl-+ClO- |
| C、盐酸于AgNO3溶液反应:HCl+Ag+=H++AgCl↓ |
| D、NaCl溶液与AgNO3溶液反应:Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
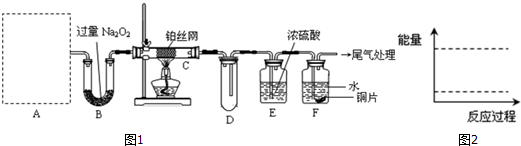
| 2 |
| 3 |
查看答案和解析>>
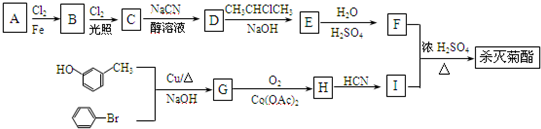
科目:高中化学 来源: 题型:
| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |
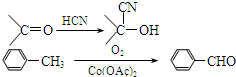
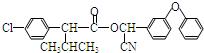 ):
):
 )的一取代物,含有碳碳叁键,X所有可能的结构共有
)的一取代物,含有碳碳叁键,X所有可能的结构共有查看答案和解析>>
科目:高中化学 来源: 题型:
| 多步氧化 |
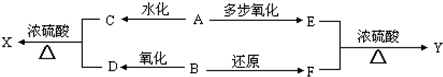
| n |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com