
【题目】【物质结构与性质】(13分)
Fe、C、N、O、H可以组成多种物质。回答以下问题:
(1)基态铁原子中,未成对电子数有 个。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],其结构如图。已知CO分子与N2分子结构相似,分子中C、O原子均能提供孤电子对形成配位键。

①CO分子中σ键与π键数目之比为 ;
②从电负性角度分析,Fe(CO)5中与Fe形成配位键的是 (填“碳”或“氧”)原子。
③与羰基铁分子的极性相似的分子是 。
A.SO2 B.CS2 C.BF3 D.PCl3
(3)CH4、H2O分子的键角分别为a、b。则a b(填>、=或<),原因是 。
(4)血红素分子结构如图所示。

①血红素分子间存在的作用力有 (填名称);
②与Fe通过配位键结合的氮原子的编号是 。
【答案】(13分)
(1)4 (2)①1:2 ② C ③ B、C
(3)> 水分子中氧原子存在孤对电子和成键电子对,甲烷分子中存在孤对电子,孤对电子产生排斥作用强于成对电子
(4)①范德华力和氢键 ②1和3
【解析】
试题分析:(1)铁是26号元素,电子排布式为1s22s22p63s23p63d64s2,根据泡利不相容原理和洪特规则知d能级上有未成对电子,由于d能级有5个轨道,所以d能级有4个未成对电子。
(2)①根据等电子体理论,CO和N2互为等电子体,氮气中存在氮氮叁键,所以CO分子中σ键与π键数目之比为1:2;
②C、O属于同周期元素,从左到右,电负性逐渐增大,则电负性C<O,所以Fe(CO)5中与Fe形成配位键的是碳原子
③根据图示,羰基铁分子构型为三角双锥,呈中心对称结构,非极性分子,A.SO2是V形分子,极性分子,B.CS2是直线形分子,非极性子,C.BF3 是平面正三角形,非极性分子,D.PCl3是三角锥分子,是极性分子,选B、C。
(3)水分子中氧原子存在孤对电子和成键电子对,甲烷分子中只存在孤对电子,孤对电子产生排斥作用强于成对电子,所以CH4、H2O分子的键角分别为a、b。则a>b。
(4)根据血红素分子结构所示①血红素分子间存在的作用力有范德华力和氢键;②与Fe通过配位键结合的氮原子的编号是1和3。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 某温度Ksp(Ag2S)=6![]() 10-50(mol·L-1)3,Ksp(AgCl)=2
10-50(mol·L-1)3,Ksp(AgCl)=2![]() 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq)
10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) ![]() Ag2S(s)+2Cl-(aq)的平衡常数约为6.7
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7![]() 1037mol·L-1
1037mol·L-1
B. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
C. pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1
D. 一定浓度的NaHS溶液在:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2S03与AgN03在不同pH下的反应进行探究
(1)测得Na2S03溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是__________;
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
②Ag2O棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为 。
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为 。
该同学设计实验确认了 a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀, 置于Na2SO3溶液中,沉淀溶解。另取Ag2SO4固体置于足量 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向x中加人过量浓HNO3,产生红棕色气体。
Ⅲ.用 Ba(NO3)2 溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是 。
②根据实验现象,分析X是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化。通过进一步实验确认了这种可能性,实验如下:

①通人Y后,瓶中白色沉淀转化为棕黑色,气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中下列各物质间不能实现![]() (“→”表示一步完成)转化的是:
(“→”表示一步完成)转化的是:
A | B | C | D | |
a | CH3CH2OH | CH2===CH2 | 硬脂酸 | HCOOCH3 |
b | CH3CHO | CH3CH2Br | 硬脂酸甘油酯 | CH3OH |
c | CH3COOH | CH3CH2OH | 硬脂酸钠 | HCOOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
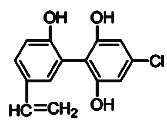
A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化工生产认识正确的是
A.海水提溴:一般需要经过浓缩、氧化、提取三个步骤
B.合成氯化氢:通入 H2 的量略大于 Cl2,可以使平衡正移
C.合成氨:采用 500℃的高温,有利于增大反应正向进行的程度
D.氯碱法:使用的粗盐事先不需要经过除杂处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。
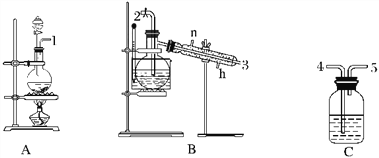
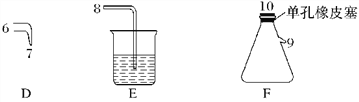
NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为71 ℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃爆炸,热水中能与水反应 |
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→____________________________________。
(2)C装置作用是_________________________________________________________________。
(3)B装置中发生反应的化学方程式为____________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为________________。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60 ℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com