
【题目】液化石油气作为燃料,已普遍进入城市家庭,它是含有下列物质的混合物,在常压下,这些物质的沸点如下表所示:
物质名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 | 69.2 |
在常温下使用至无气体放出时,钢瓶中常剩余一些液态物质,这些物质最有可能是( )
A. 乙烷、丙烷和丁烷 B. 乙烷和丙烷
C. 只有乙烷 D. 戊烷和己烷
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】I.减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击时化学键一定断裂
D.NaN3、NH4NO3均属于离子化合物
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
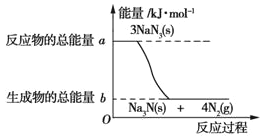
①叠氮化钠的爆炸反应属于_______(填“吸热”或“放热”)反应。
②若爆炸过程中有18mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为______kJ,消耗叠氮化钠的质量为_________g。
③若安全气嚢的体积为VL,NaN3的爆炸在ts内完成,反应过程中消耗292.5g NaN3,则用N2表示的反应速率为____________。
II.(3)已知X、Y、Z、W分别是元素周期表中的短周期元素,且原子序数依次增大。X、W为同主族元素,Y、Z为同周期的相邻元素。W原子的质子数等子Y、Z原子的最外层电子数之和。Y与X形成的分子中含有3个共价键,X、Y、Z所形成的常见化合物是汽车安全气囊中的一种填充物。请回答下列问题:
①写出X、Y、W形成化合物的电子式___________。
②一定温度下,X2、Y2在容积为5L的密闭容器中发生可逆反应,充入的X2和Y2的物质的量分别是6mol和3mol,达到化学平衡状态时生成物的物质的量为2.4mol。达到化学平衡状态时,混合气体中Y2的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中,正确的是( )
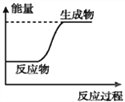
A. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量少
B. 如图可表示C和H2O(g)反应过程中的能量变化
C. 吸热反应一定要加热,才能进行
D. 已知中和热为57.3 kJ·mol-1,则浓硫酸与NaOH溶液反应生成 1mol H2O时, 共放出57.3 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右,下列说法不正确的是
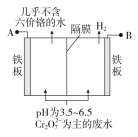
A.A为电源正极
B.阴极区附近溶液pH降低
C.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)画出元素⑧的原子结构示意图 __________________
(2)在这些元素中,最活泼的非金属元素是 ______, 最不活泼的元素是_____(写元素符号 )。
(3)在这些元素的最高价氧化物对应水化物中, 碱性最强的是 __________(写化学式),呈两性的氢氧化物是____________(写化学式),写出两者之间反应的离子方程式: ______________________________
(4)在⑥与⑨中,化学性质较活泼的是________(写元素符号 ),写出可以验证该结论的一个化学反应方式 _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
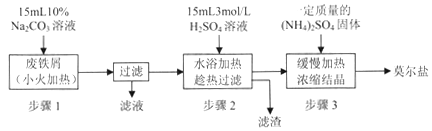
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
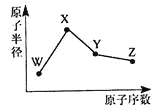
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱图如下:
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。如下图A。
方法三:利用红外光谱仪测得A分子的红外光谱,如下图B。
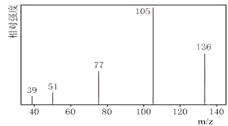
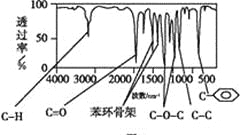
图A 图B
已知:A分子中只含有一个苯环,且苯环上只有一个取代基,试回答下列问题。
(1)分子中共有 种化学环境不同的氢原子。
(2)A的分子式为 。
(3)该物质属于哪一类有机物 。
(4)A的分子中只含一个甲基的依据是 (填序号)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d .A分子的红外光谱图
(5)A的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关CaCO3的溶解平衡的说法中,不正确的是( )
A. CaCO3沉淀析出和沉淀溶解不断进行,但速率相等
B. CaCO3难溶于水,其饱和溶液几乎不导电,属于弱电解质溶液
C. 升高温度,CaCO3沉淀的溶解度增大
D. 向CaCO3沉淀中加入纯碱固体,CaCO3的溶解度降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com