
分析 (1)泥沙不溶于水;
(2)壬烷、己烷互溶,但沸点不同;
(3)KNO3、NaCl的溶解度受温度影响不同;
(4)乙酸与碳酸钠反应后,与乙酸乙酯分层;
(5)乙烯与溴水反应,而甲烷不能;
(6)CaO与水反应后,增大与酒精的沸点差异.
解答 解:(1)泥沙不溶于水,利用过滤法分离;
(2)壬烷、己烷互溶,但沸点不同,选择蒸馏法分离;
(3)KNO3、NaCl的溶解度受温度影响不同,选择结晶法分离;
(4)乙酸与碳酸钠反应后,与乙酸乙酯分层,则加碳酸钠溶液、分液分离;
(5)乙烯与溴水反应,而甲烷不能,则利用溴水、洗气分离;
(6)CaO与水反应后,增大与酒精的沸点差异,则加CaO后蒸馏分离,
答:(1)~(6)的分离方法分别为过滤、蒸馏、结晶、分液、洗气、蒸馏.
点评 本题考查混合物分离提纯的方法及选择,为高频考点,把握物质的性质、性质差异及混合物分离原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2不溶于水,也不溶于酸和碱 | B. | SiO2是制造太阳能电池的常用材料 | ||
| C. | 硅是地壳中含量最多的非金属元素 | D. | 水玻璃可用作木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
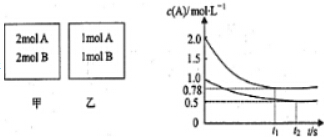
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶、量筒、滴定管等仪器时,先用水洗后还需待装液润洗 | |
| B. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| C. | 为提升燃料电池的效率,通常可以用KNO3代替蒸馏水,同时作电极的碳棒先灼烧,然后投入到冷水中,反复3-5次 | |
| D. | 在制取乙酸乙酯的实验中,收集乙酸乙酯的试管中加的是饱和Na2CO3溶液,而且导管直接插入到饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
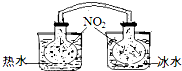 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
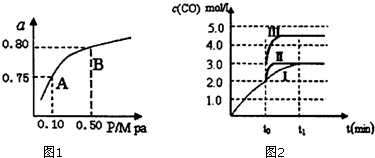
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com