
| A. | CaO中混有CaCO3(高温煅烧) | B. | CO混有CO2(石灰水) | ||
| C. | H2中混有HCl(NaOH溶液) | D. | Ca(OH)2中混有CaCO3(盐酸) |
科目:高中化学 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2mol•L-1 | |
| B. | 该硫酸50mL与足量的铜反应可得到标准状况下SO2 10.3L | |
| C. | 配制50mL 4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 4.6gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| C. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始时的速率:甲>乙 | |
| B. | 反应结束时,pH值:甲=乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲=乙 | |
| D. | 反应所需时间:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
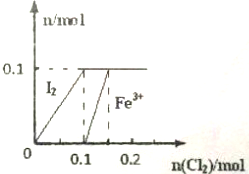 某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应一定有氧元素参加 | |
| B. | 氧化还原反应的本质是电子的转移 | |
| C. | 物质中某元素失去电子,则此物质是氧化剂 | |
| D. | 某一反应中有元素化合价的变化,则该反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入明矾可以起到净水作用 | |
| B. | 热糖水降低温度后有固体析出,则原热糖水一定是饱和溶液 | |
| C. | 配制溶液时搅拌可以增大溶质的溶解度 | |
| D. | 物质溶于水时不会放出热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com