
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
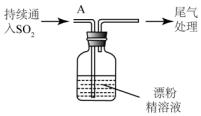 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
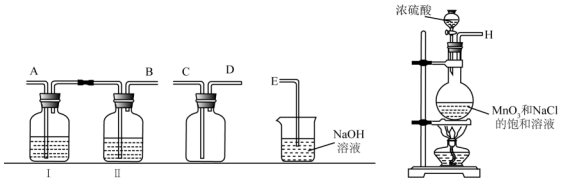
分析 (1)按照气体的制备、除杂、收集、尾气处理的步骤连接实验装置;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(3)①pH试纸先变蓝(约为12),后褪色说明溶液呈碱性,具有漂白性;
②检验盐酸要排除氯气的干扰据此分析;
③溶液呈黄绿色,有Cl2生成;SO2被氧化为SO42-,硫酸根离子和钙离子结合生成微溶物硫酸钙.
解答 解:(1)实验室制取氯气时,首先要制取氯气,然后通过饱和食盐水除去挥发出来的氯化氢气体,通过浓硫酸除去混入的水蒸气,这时得到了干燥、纯净的氯气,要用向下排空气法收集氯气,最后要吸收多余的氯气,注意防止倒吸,仪器连接为H→A→B→C→D→E,
故答案为:A;B;C;D;E;饱和食盐水;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)①pH试纸先变蓝(约为12)溶液呈碱性,后褪色溶液具有漂白性,所以说明溶液呈碱性,具有漂白性;故答案为:碱性、漂白性;
②因氯气与酸化的AgNO3溶液反应也产生白色沉淀,故检验盐酸,应先排除氯气的干扰,故答案为:排除氯气干扰;
③溶液呈黄绿色,有Cl2生成;取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4,故答案为:Cl2;CaSO4.
点评 本题考查探究实验,根据实验现象分析物质的性质,同时考查学生分析问题、总结问题能力,注意:不能用pH试纸测定氯水pH值,次氯酸有漂白性导致测定不准确,为易错点.


 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 用作净水剂:Fe3++H2O?Fe(OH)3+3H+ | |
| B. | 用于制印刷电路的腐蚀液:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 与小苏打溶液反应:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ | |
| D. | 遇KSCN 溶液变红色:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
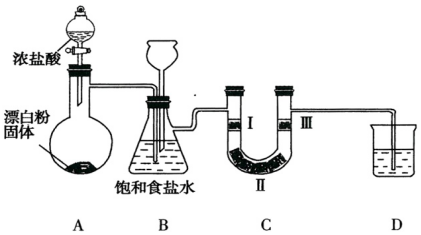
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 15 | C. | 16 | D. | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L甲醇中含有的分子数为0.5NA | |
| B. | 4.4gN2O和CO2的混合气体中含有的原子数为0.3NA | |
| C. | 4.2g乙烯和丙烯混合气体中含有的共价键数为0.6NA | |
| D. | 25°C时,1.0L,PH=13 的 Ba(OH)2 溶液中含有的OH-数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com