
 X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.
X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.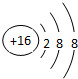 ;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.
;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.分析 (1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,即X为Ca、Y为Cl,故XY2是CaCl2;
CaH2属于离子化合物,由钙离子与氢负离子构成;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;E有2个电子层,最外层电子数为4,则E为碳元素;
(3)短周期元素W与Y同周期,其单质是半导体材料,则W为Si,元素Z的单质分子Z2中有3个共价键,则Z为N元素,Si与N形成一种新型无机非金属材料为Si3N4;
(4)①非金属性越强,氢化物越稳定;
②非金属性越强,最高价氧化物对应水化物的酸性越强.
解答 解:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,即X为Ca、Y为Cl,故XY2是CaCl2,用电子式表示形成过程为 ,
,
CaH2属于离子化合物,由钙离子与氢负离子构成,电子式为[H:]-Ca2+[:H]-,
故答案为:CaCl2; ;[H:]-Ca2+[:H]-;
;[H:]-Ca2+[:H]-;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,硫离子结构示意图为: ,E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,D所在族元素的氢化物中,水分子之间形成氢键,沸点高于其它氢化物,其它氢化物中硫化氢相对分子质量最小,故沸点最低的是 硫化氢;X与E形成的离子化合物CaC2中有共价键,
,E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,D所在族元素的氢化物中,水分子之间形成氢键,沸点高于其它氢化物,其它氢化物中硫化氢相对分子质量最小,故沸点最低的是 硫化氢;X与E形成的离子化合物CaC2中有共价键,
故答案为: ;S=C=S;硫化氢;有;
;S=C=S;硫化氢;有;
(3)短周期元素W与Y同周期,其单质是半导体材料,则W为Si,元素Z的单质分子Z2中有3个共价键,则Z为N元素,Si与N形成一种新型无机非金属材料为Si3N4,
故答案为:Si3N4;
(4)①非金属性Cl>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HCl>H2S,
故答案为:HCl>H2S;
②非金属性Cl>S,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>H2SO4,
故答案为:HClO4>H2SO4.
点评 本题考查结构性质位置关系、常用化学用语、物质结构与性质、元素周期律等,难度不大,注意基础知识的理解掌握.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①④ | B. | 只有③⑤ | C. | 只有②③ | D. | 只有①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同素异形体 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se物理性质和化学性质均相同 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3BO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
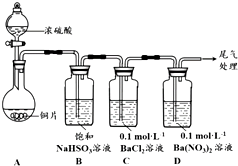 甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
甲乙两同学分别对含+4价硫元素的物质性质进行了探究.| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 通入空气的一极是正极,电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 通入甲烷的一极是负极,电极反应为:CH4+8e-+4O2-═CO2+2H2O | |
| D. | 当电路中通过amol电子时,理论上能生成标准状况下CO2气体2.8aL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的SO3中 | B. | O2和SO3中 | C. | 剩余的SO3中 | D. | O2、SO2和SO3中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com