
A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y );D形成的分子为双原子分子。回答问题:
(1)D元素的名称为 , F形成的离子的结构示意图为 。
(2)写出液态化合物Y的一种用途 。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式 ________ ,使用这种气球存在的隐患是 。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式: 。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为 。
(1)氟 
(2)一定浓度的H2O2溶液作消毒剂
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑ 易燃、易爆
(4)H++HSO3-=SO2↑+H2O
(5)NH3+HCl=NH4Cl
【解析】E原子半径在短周期主族元素中最大,E为Na;A与E最外层电子数相同,A、E同主族,A为H;C元素在第二周期,H元素与C元素形成两种常见的液态化合物,C为氧元素;F质子数是C的2倍,F为S;B、C同周期且相邻,B为N;D为F;G为Cl。
(1)D元素名称为氟,S2-的结构示意图为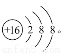
(2)化合物Y为H2O2,可以作医用消毒剂和漂白剂等。
(3)Al与NaOH溶液反应产生H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。氢气球存在的问题是易燃、易爆。
(4)H、O、Na、S形成的化合物都显酸性,则为NaHSO4和NaHSO3,反应的离子方程式为:H++HSO3-=SO2↑+H2O。
(5)H、N、Cl三种元素形成的NH3与HCl反应的化学方程式为:NH3+HCl=NH4Cl。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:选择题
相同体积,相同PH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )

查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 6化学反应与能量练习卷(解析版) 题型:选择题
下列热化学方程式书写正确的是( )
A.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ/mol
B.2SO+O2=2SO3 ΔH=-196.6 kJ/mol
C.H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
D.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-2元素周期表 元素周期律练习卷(解析版) 题型:填空题
黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)。
A+N2↑+3CO2↑(已配平)。
(1)生成物中除了氮气与二氧化碳外,还有一种物质A,则A的电子式为 ,A属于________化合物。
(2)黑火药中位于元素周期表短周期的元素有 种。其中一种元素的单质可用于制药,其氧化物可用于漂白织物和作防腐剂,该元素在周期表中的位置是 。
(3)黑火药中所含元素的原子半径从大到小的顺序是 (用元素符号表示);
(4)下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的有 。
A.同条件同浓度溶液的pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-2元素周期表 元素周期律练习卷(解析版) 题型:选择题
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
D.元素周期表中位于金属和非金属的分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-1原子结构原子核外电子排布练习卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是( )
A. S2-的结构示意图为:
B.质子数为53、中子数为78的碘原子:13153I
C. F-的结构示意图:
D.由含有2个中子的氢原子与10个中子的氧原子形成的水分子的化学式可表示为:21H2188O
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 4-4氮及其重要化合物练习卷(解析版) 题型:简答题
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:___________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。

①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至____________后,迅速关闭K1,观察到U形管内的现象是_______________________________________________________________。
②装置Ⅲ中发生反应的化学方程式为__________________________________。
③蘸NaOH溶液的棉花团的作用是_______________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 4-3硫及其重要化合物练习卷(解析版) 题型:选择题
甲、乙、丙、丁四种易溶于水的物质,分别由 、Ba2+、Mg2+、H+、OH-、Cl-、
、Ba2+、Mg2+、H+、OH-、Cl-、 、
、 中的不同阳离子和阴离子各一种组成,已知:
中的不同阳离子和阴离子各一种组成,已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙容器中滴入AgNO3溶液有不溶于稀硝酸的白色沉淀生成,下列结论不正确的是( )
A.甲溶液含有Ba2+ B.乙溶液含有SO42+
C.丙溶液含有Cl- D.丁溶液含有Mg2+
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 3-3铁及其重要化合物练习卷(解析版) 题型:选择题
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
操作、现象解释
A向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝Fe3+能与淀粉发生显色反应
B把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点铁在潮湿的空气中易生成Fe(OH)3
C向稀硝酸中加入少量铁粉,有气泡产生说明Fe置换出硝酸中的氢,生成了氢气
D新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色说明Fe(OH)2易被O2氧化成Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com