
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
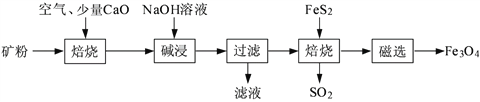
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为__________。
(2)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(3)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
【答案】SO2+OH![]() HSO3NaAlO2Al(OH)31∶16
HSO3NaAlO2Al(OH)31∶16
【解析】
(1)用NaOH溶液吸收过量SO2生成HSO3-;
(2)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,“过滤”得到的滤液中主要含有AlO2-,向“过滤”得到的滤液中通入过量CO2,可以将AlO2-转化为Al(OH)3
(3)“过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2,混合在缺氧条件下,焙烧生成Fe3O4和SO2,由电子得失守恒计算。
(1)用NaOH溶液吸收过量SO2生成HSO3-,反应的离子方程式为:SO2+OH-═HSO3-;
(2)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,“过滤”得到的滤液中主要含有AlO2-,向“过滤”得到的滤液中通入过量CO2,可以将AlO2-转化为Al(OH)3;
(3)过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,设有amolFe2O3和bmolFeS2完全参加反应,根据电子得失守恒:2a×(3-8/3)=2b×5+b×(8/3-2),解得a/b=16,所以理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16。


科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:

①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1 mol该化合物最多可与2 mol Br2发生反应。
其中正确的是( )
A. ②③ B. ①②④ C. ①③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下:
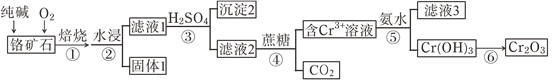
已知:主要反应是:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2
4Na2CrO4+4CO2
Cr2![]() +H2O
+H2O![]() 2Cr
2Cr![]() +2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
(1)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为:_______;
(2)步骤⑤中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10-5mol·L-1],pH至少调至_____;
(3)滤液3中的主要溶质是两种盐,化学式为_____、________;
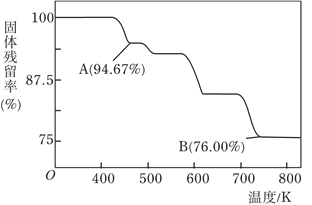
(4)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时剩余Cr的氧化物化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去括号内杂质所选试剂正确的是( )
A. Cu(CuO):稀硝酸B. FeCl3(AlCl3):氨水
C. Fe2O3(SiO2):NaOH溶液D. CO2(HCl):饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砹(At)是卤族元素中位于碘后面的元素,下列有关砹的说法不正确的是( )
A.最外层有7个电子B.原子半径比碘大
C.易失去电子D.得到电子能力比碘弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学探究的基本程序包括形成问题、建立假设、设计研究方案、检验假设、表达或交流结果等.某同学欲用如图装置可用来探究浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,请填写下列空白:

(1)写出木炭粉与浓硫酸反应的化学方程式____________
(2)②中品红溶液A的作用是 ______ .酸性高锰酸钾的作用______品红溶液B的作用是______。
(3)如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③:则可以检出的物质是_____,不能检出的物质是_____ 。
(4)如果将仪器的连接顺序变为①、③、②,则不能检出的物质是 ______。
(5)如果将仪器的连接顺序变为②、③、①,则不能检出的物质是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B. 常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
C. 将0.2 mol FeCl3水解制成胶体,所得胶体粒子数为0.2NA
D. 50 mL12 mol/L盐酸与足量MnO2共热,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙烯时,产生的气体能使溴水褪色,甲、乙同学用下列实验验证。
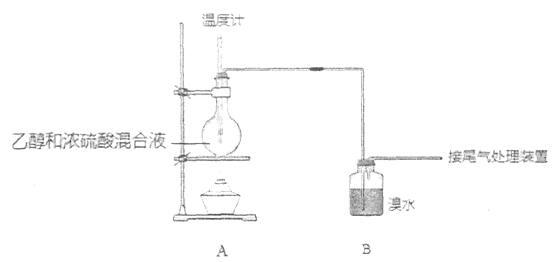
(气密性已检验,部分夹持装置略)。实验操作和现象为:
操作 | 现象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)烧瓶内产生乙烯的化学方程式是________。
(2)溶液“渐渐变黑”,说明浓硫酸具有________性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是________。
②乙根据现象III认为产生了SO2,在B中与SO2反应使溶液褪色的物质是________。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
设计 | 现象 | |
甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | 溴水褪色 |
乙 | 与A连接的装置如下:
| D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
a. 根据甲的设计,洗气瓶中盛放的试剂是________。
b. 根据乙的设计,C中盛放的试剂是________。
c. 能证明确实是SO2使E中溶液褪色的实验是________。
d. 乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是________。
(4)上述实验得到的结论是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com