
(16分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
① 若X和Y均为惰性电极,a为CuSO4溶液,则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+,,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
⑴C ⑵H2+2OH--2e-=2H2O ⑶①4OH--4e-=2H2O+O2↑
通电
2CuSO4+2H2O====2Cu+O2↑+2H2SO4 0.4mol
Fe-2e-=Fe2+ ③粗铜 减小 ④阴极 不变
解析(1)原电池的组成条件包括:“两级、一线、一液、一回路、一个自发的氧化还原反应”,再有原电池的反应通常是放热反应的信息选C
(2)氢氧燃料电池,碱性电解质系统的负极反应为H2+2OH--2e-=2H2O
(3)电解池装置图可知Y是阳极,X是阴极。
① 若X和Y均为惰性电极,a为CuSO4溶液,则阳极的电极反应式为4OH--4e-=2H2O+O2↑
通电
2CuSO4+2H2O====2Cu+O2↑+2H2SO4 加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,说明电解中阴极铜离子得0.4mol电子。
②若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+, 铁做阳极,铁失去电子Fe-2e-=Fe2+
③若用此装置电解精炼铜,粗铜作阳极,精铜作阴极,硫酸铜溶液做电解质,电精炼过程阳极粗铜中金属性比同强的金属都失去电子,溶液中的铜离子在阴极得到电子,故电解质溶液的浓度减小。
④若用此装置在铁制品上镀铜,镀层金属做阳极,镀件做阴极,含有镀层金属的盐溶液做电解质,电镀过程电解质浓度不变。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
① 若X和Y均为惰性电极,a为CuSO4溶液,
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013届河南省宜阳一高高二3月月考化学试卷 题型:填空题
(10分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
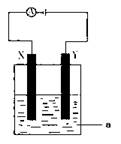
① 若X和Y均为惰性电极,a为CuSO4溶液,
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013届山东省高二上学期模块考试化学试卷 题型:填空题
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
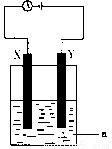
① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com