
| 46×0.2g |
| 2 |
| 4.6g |
| 17g |
| 46 |
| 62 |


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
| A、KHCO3溶液中混有K2CO3 ( CO2 ) |
| B、Mg中混有Al ( NaOH溶液 ) |
| C、Fe2O3中混有Al2O3 ( NaOH溶液) |
| D、Fe中混有Fe2O3 ( 盐酸 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
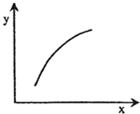 在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)═3C(g)△H<0,达到平衡后,改变一个条件(x),如表量(y)一定符合图中曲线的是( )
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)═3C(g)△H<0,达到平衡后,改变一个条件(x),如表量(y)一定符合图中曲线的是( )| 选项 | x | y |
| A | 降温 | A的体积分数 |
| B | 升高温度 | 混合气体的密度 |
| C | 再加入A | B的转化率 |
| D | 再加入C | A的体积分数 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校学习小组进行下述实验,探究CH3COOH、H2CO3和H2SiO3
某校学习小组进行下述实验,探究CH3COOH、H2CO3和H2SiO3查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com