
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
 CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
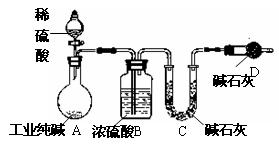
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
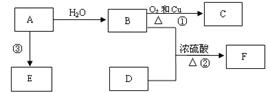

|
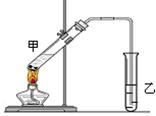
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
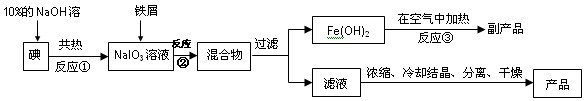
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 种群 | 甲 | 乙 | 丙 | 丁 |
| 能量(kJ) | 2.8×109 | 1.3×108 | 9.1×107 | 2.9×107 |
| DDT浓度(ppm) | 0.04 | 0.35 | 0.39 | 3.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。 =4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。
=4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨工业选择的反应条件不是室温,是500℃左右 |
| B.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.硫酸工业中,使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ,在反应过程中,
2NH3(g) ,在反应过程中, t1、t2、t3、t4时条件改变,正反应速率发生变化,如右图,对于可能的条件改变下列判断正确的是
t1、t2、t3、t4时条件改变,正反应速率发生变化,如右图,对于可能的条件改变下列判断正确的是
A.t1时可能升高了温度 | B.t2时可能使用了催化剂 |
C.t3时可能减小了压强 | D.t4时可能降低了温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com