
(16分)将NaHCO3固体放入真空容器中发生下列反应
2NaHCO3(s)= Na2CO3(s)+ H2O(g)+ CO2(g)
已知298K时有下列数据:
物质 | NaHCO3 (s) Na2CO3(s) H2O(g) CO2(g) |
| -947.7 - 1130.9 -241.8 -393.5 |
| 102.1 136.6 188.7 213.6 |
7-1 求298K时平衡体系的总压力;
7-2 体系的温度为多高时,平衡压力为101.3kPa;
7-3 298K的大气中,H2O(g) 与CO2(g)的分压分别为3167Pa与30.4Pa,将纯NaHCO3固体放入大气中让其发生上述分解反应。
(1)问此时该分解反应的![]() 比
比![]() 大还是小?为什么?
大还是小?为什么?
(2)用QP与![]() 比较说明NaHCO3固体迅速分解还是稳定存在?
比较说明NaHCO3固体迅速分解还是稳定存在?
(3)用吉布斯自由能判据说明NaHCO3固体迅速分解还是稳定存在? [视H2O(g) 与CO2(g)为理想气体]
7-1 ![]() =
= ![]() +
+![]() +
+![]() -2×
-2×![]()
= -1130.9 -241.8 -393.5+2×947.7=129.2 kJ.mol-1
![]() =
= ![]() +
+![]() +
+![]() -2×
-2×![]()
= 136.6 +188.7 + 213.6 -2×102.2 =334.7 J.K-1.mol-1
![]() =
= ![]() -
-![]() =129.2×103-298×334.7
=129.2×103-298×334.7
= 29460 J.mol-1 = 29.46 kJ.mol-1
![]()
![]()
设平衡时的总压为P,则
![]() = 6.854×10-6
= 6.854×10-6
P = 530 Pa (4分)
7-2 平衡压力为101.3 kPa时的![]()
根据等压方程式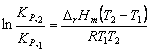
则 ![]()
T = 373.1 K (2分)
7-3 (1)298K的大气中该分解反应的![]() 比
比![]() 大。因为H2O(g) 与CO2(g)皆由标准状态分别变为分压3167Pa和30.4Pa,为等温膨胀过程熵值均增大,而NaHCO3 (s) 和Na2CO3(s)的熵值不变,所以
大。因为H2O(g) 与CO2(g)皆由标准状态分别变为分压3167Pa和30.4Pa,为等温膨胀过程熵值均增大,而NaHCO3 (s) 和Na2CO3(s)的熵值不变,所以![]() 比
比![]() 大。 (2分)
大。 (2分)
(2)![]()
![]()
所以NaHCO3固体不分解而稳定存在。 (2分)
(3)![]()
![]()
![]() = 29460
= 29460![]()
= 776.8 J.mol-1 >0
所以NaHCO3固体不分解而稳定存在。 (2分)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NaHCO3固体加入新制的氯水中,有无色气泡(H+) | B、将红色布条放入新制的氯水中,布条退色(HCl) | C、将SO2通入新制的氯水中,溶液退色(Cl2) | D、将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com