
 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L H2SO4溶液和NaOH溶液.填写下列空白:
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L H2SO4溶液和NaOH溶液.填写下列空白:

科目:高中化学 来源: 题型:
 如图所示装置可用于多种实验.
如图所示装置可用于多种实验.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室可用如图所示的装置制取气体,下列有关说法正确的是( )
实验室可用如图所示的装置制取气体,下列有关说法正确的是( )| A、实验室不能用这种装置来制取氢气 | B、这种装置可以不用加热试管来检查装置的气密性 | C、食盐跟浓硫酸反应制氯化氢的实验能用这种装置 | D、利用这种装置制取乙炔可以随制随停 |
查看答案和解析>>
科目:高中化学 来源: 题型:
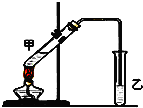 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高一化学(下) 题型:022
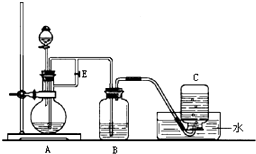
已知 ,如图所示装置可用来制取
,如图所示装置可用来制取 并比较S元素与Br元素非金属性的强弱.
并比较S元素与Br元素非金属性的强弱.

(1)将下列操作步骤补充完整:
①______________________________________________________________________________
②用大火加热使S粉沸腾与 化合;
化合;
③______________________________________________________________________________
④停止加热并做善后处理.
(2)Ⅰ中制 不直接用稀
不直接用稀 与Zn反应;而将浓
与Zn反应;而将浓 滴入水中,其优点是________.
滴入水中,其优点是________.
(3)Ⅲ中发生的现象是________,得出的结论是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com