
某化学课外小组利用下图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成。

请回答下列问题:
(1)仪器A的名称是 。
(2)甲装置的c应该与乙装置的 连接(填“d”或“e”)。
(3)乙装置中反应的化学方程式是 。
(4)实验步骤如下:
i仪器组装完毕,检查装置的气密性,加入试剂。打开旋塞a,通入N2一段时间后,关闭旋塞a。
ii打开旋塞b,滴加入xmol·L-1浓硝酸V mL,充分反应后冷却,固体仍有剩余。
iii用NaOH溶液滴定乙装置中溶液,得溶质的物质的量为n mol。
①步骤i通入N2的目的是_______ _
②为了准确测定甲装置中产生NO2的量,在步骤ii和iii之间应补充的操作是: 。
③当xV×l0-3 3n(填 “>”、“=”或“<”),则证明铜与浓硝酸反应时有NO生成。
④该实验设计中存在一个明显的缺陷是 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届江苏省泰州中学高三上学期期中考试化学试卷(带解析) 题型:填空题
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。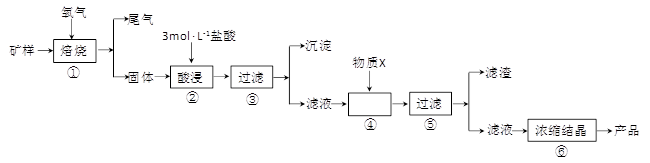
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。

已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
|
金属离子 |
氢氧化物开始沉淀的pH |
氢氧化物沉淀完全的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用右图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______、______

(2)培烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______、______
(3)步骤②酸浸过程中,需要用到3mol·L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________
(4)步骤④加入物质X的目的是_____,物质X可以选用下列物质中的_____。
A.氢氧化钠 B.稀盐酸 C.氨水 D.氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol·L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]= _____。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。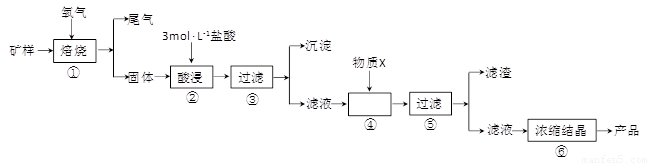
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
|
金属离子 |
氢氧化物开始沉淀的pH |
氢氧化物沉淀完全的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
回答下列问题:
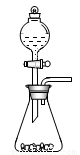
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
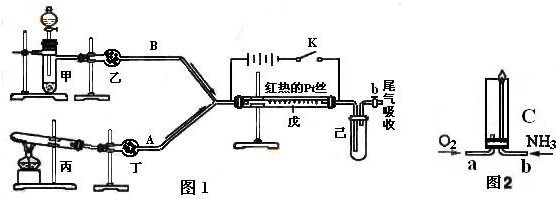
某化学课外小组设计了如下图所示的装置,进行氨气性质实验。利用下图完成氨的催化氧化实验,其中箭头表示气体流向,A、B表示两种纯净、干燥的气体,反应进行一段时间后,装置已中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取KMnO4、Na2O2、NH4Cl、NH4HCO3、P2O5、碱石灰、生石灰、蒸馏水、浓硫酸、浓氨水
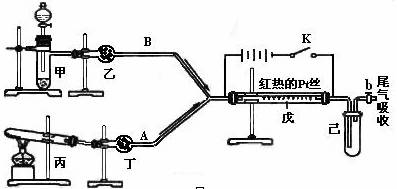
根据图I中装置和反应现象请回答:
(1)若乙中盛有P2O5,此时丙装置中发生反应的化学方程式为____________________。若丁中盛有P2O5,此时甲装置中应选择的试剂是____________________________。
(2)检验甲装置气密性的方法_________________________________________________
____________________________________________________________________________。
(3)当乙中充满红棕色气体后,停止甲、丙装置中的反应,并关闭a、b两个活塞,将己装置浸入冰水中,出现的现象是_______________________________________简述产生此现象的原因___________________________________________________________________
_______________________________________________________________________。
若将乙装置中的试管倒置于盛有水的水槽中,发生的现象是________________________。
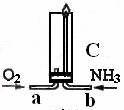
(4)已知氨气在纯氧中安静的燃烧,如下图,将过量O2与NH3分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气。先通入O2,后通过NH3的理由是
_____________________________________________________________________。
(5)液氨与水性质颇为相似,其电离方程式可表示为:2NH3![]() NH4++NH2-。某温度下其离子积常数为1×10-30(mol?L-1)2。液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡____________移动(填“向正方向”“向逆方向”或“不”),完全反应后溶液的pNH4=__________。
NH4++NH2-。某温度下其离子积常数为1×10-30(mol?L-1)2。液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡____________移动(填“向正方向”“向逆方向”或“不”),完全反应后溶液的pNH4=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com