
����Ŀ��ʵ����������1mol/L NaOH��Һ240ml����ش�
��1�����ȡNaOH����____________g��������Ϊ23.1 g���ձ�����������ƽ�ϳ�ȡ����NaOH����ʱ�����ڸ�����ѡȡ����������С___________(����ĸ)��������ͼ��ѡ������ȷ��ʾ����λ�õ�ѡ��____________(����ĸ)��
����������
a | b | c | d | e | |
�����С/g | 100 | 50 | 20 | 10 | 5 |
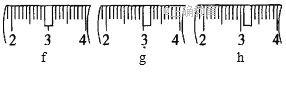
��2��ѡ�õ���Ҫ�����������ձ������������_____________________________��
��3�����в�����˳���ǣ�����ű�ʾ��_________________��
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ����
B������ƽȷ��ȡ�����NaOH����������������ˮ���ò���������������ʹ�����ܽ�
C��������ȴ��NaOH��Һ�ز�����ע������ƿ��
D��������ƿ�ǽ����ߵ�ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
��4����������������Ƶ�NaOH��ҺŨ���к�Ӱ�죿������ƫ������ƫС������Ӱ������д��
������ƿ������ϴ�Ӻ������������ˮ________________
�����ȵ���Һֱ������������ƿ________________
������ʱ����������ƿ�Ŀ̶���________________
��ת����Һʱ�����������¶�������ƿ�Ŀ̶�������________________
���𰸡� 10.0 cd h 250ml����ƿ ��ͷ�ι� BCAFED ��Ӱ�� ƫ�� ƫС ƫС
��������(1)����240mL1molL-1NaOH��Һ��Ҫ�������Ƶ�����Ϊ0.25L��1mol/L��40g/mol=10.0g��
�������ƾ��и�ʴ�����׳��⣬Ӧ�����ձ��ڳ��������������������ձ�������Ϊ10.0g+23.1g=33.1g����Ӧѡ��20g��10g�����룬��ѡ��cd���ɱ������߿�֪����С������Ϊ5g������������̶�Ϊ5g����С��5g����������Ӧ��3.1g��λ�ã���ѡ��h��
(2)�������һ�����ʵ���Ũ�ȵ���Һ����������裬��Ҫ�õ���������������ƽ��ҩ�ס��ձ���������������ƿ����ͷ�ιܣ�����250mL1.0mol/L��NaOH��Һ��Ӧѡ��2500mL����ƿ����ȱ�ٵIJ���������250ml����ƿ�ͽ�ͷ�ιܣ�
(3)����һ�����ʵ���Ũ�ȵ���Һһ����������ǣ����㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ�������˳��ΪBCAFED��
(4)��������������Ƶ�NaOH��ҺŨ���к�Ӱ�죿(����ƫ������ƫС������Ӱ������д)
��������ƿδ���T����������Һ������ҺŨ����Ӱ�죬��ΪֻҪ����ʱ��ȷ������ˮ��ԭ�����еĻ��Ǻ�������ģ���Ũ����Ӱ�죻
�ڽ��ȵ���Һֱ������������ƿ�����ݺ���Һ��ȴҺ����½�������Һ�����ƫС����ҺŨ��ƫ��
�۶���ʱ����Һ�棬������Һ���ƫ����Ũ�Ȼ�ƫС��
��ת����Һʱ���������¶˿�������ƿ�̶������ϣ���̶����ϸ��ŵ���Һ��������Һ���ƫ��Ũ��ƫС��


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A�������£���0.1mol��L-1��HNO3��Һ�У���ˮ�������c(H+)��![]()
B��Ũ��Ϊ0.1mol��L��1��NaHCO3��Һ��c��H2CO3����c��CO32����
C��25��ʱ��AgCl�����ڵ����ʵ���Ũ�ȵ�NaCl��CaCl2��Һ�е��ܶȻ���ͬ
D������������μ�ˮ����Һ�ĵ����ԡ�����ĵ���̶ȡ�pH����������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Σ�3PbO��PbSO4��H2O����Է�������Ϊ990��������������ϩ�����ȶ����� ������ˮ����200.0tǦ�ࣨ��Ҫ�ɷ�ΪPbO��Pb��PbSO4�ȣ�Ϊԭ���Ʊ����εĹ�����������ͼ��ʾ��

��֪��Ksp(PbSO4)=1.82��l0-8��Ksp(PbCO3)=l.46��l0-13��
�ش��������⣺
��1����Na2CO3��Һת����Ŀ����_________.
��2������ʱ,��ֱ��ʹ��H2SO4��Һ��ԭ�������________;Ǧ�����������ܹ����з�����Ӧ�����ӷ���ʽΪ__________.
��3�������п�ѭ�����õ�������_________��ϴ�Ӳ���ʱ����������Ƿ�ϴ�Ӹɾ��ķ�����________��
��4��������ת����ƽ��ʱ����Һl��c(SO42-)��c(CO32-)�ı�ֵΪ_____________��
��5�� 50-60��ʱ�ϳ����εĻ�ѧ����ʽΪ______�����õ��������������99.0t������Ǧ���е�ǦԪ����80��ת��Ϊ���Σ���Ǧ����ǦԪ�ص���������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������������������Ĵ�������������������о����ȵ����⡣
��������β���е�NO��CO�������ڼ���PM2.5���ŷš���֪������Ϣ��
2CO(g)��2NO(g)![]() 2CO2(g)��N2(g)����H1����748kJ��mol��1
2CO2(g)��N2(g)����H1����748kJ��mol��1
2CO(g)��O2(g)===2CO2(g)����H2����565kJ��mol��1
(1)��һ��������N2��O2��ת��ΪNO��д���÷�Ӧ���Ȼ�ѧ����ʽ��_________��
(2)Ϊ�о���ͬ�����Է�Ӧ��Ӱ�죬�ں��������£���2L�����ܱ������м���0.2molNO��0.4mol CO���ڴ������ڵ������·�����Ӧ��10minʱ��Ӧ�ﵽƽ�⣬���10min��v(NO)��7.5��10��3mol��L��1��min��1����ƽ���n(CO)��________mol�����ڸ�ƽ�������˵����ȷ����________��
a������ѹǿ��ƽ��һ�������ƶ�
b�������������䣬�����¶ȣ���ѧ��Ӧ����һ������
c�������������䣬����Ϊ�ں�ѹ�����н��У�CO��ƽ��ת���ʱȺ��������´�
d���ﵽƽ���v��(NO)��2v��(N2)
(3)����������ͬ��t minʱ��ͬ�¶��²��NO��ת������ͼ��ʾ��

A��ķ�Ӧ�ٶ�v��________(�����������������)v����A��B���㷴Ӧ��ƽ�ⳣ���ϴ����________(�A����B��)��
(4)��֪HNO2�ĵ��볣��Ka��7.1��10��4mol��L��1��
NH3��H2O�ĵ��볣��Kb��1.7��10��5mol��L��1
��0.1mol��L��1NH4NO2��Һ������Ũ���ɴ�С��˳����____________________________��
������NO2-ˮ�ⷴӦ��ƽ�ⳣ��Kh��________(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��NO��������β���е��к����ʣ�����֮���ܻ����ط������·�Ӧ��2NO(g)��2CO(g)![]() N2(g)��2CO2(g)
N2(g)��2CO2(g)
��H��0�������ô˷�Ӧ�������һ�ֻ���װ�ã�������������β���Դ�������Ⱦ��������Ʒ����������β������Ч�ʵ���( )
��ѡ���ʵ��Ĵ��� �����װ���¶� �۽���װ�õ�ѹǿ ��װ���з����ʯ��
A. �٢� B. �ڢ�
C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ne��������Ų���ͬ�Ұ뾶������
A. F- B. O2- C. Cl- D. Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol/L������ֱ�ΪVa��Vb��HA��Һ��BOH��Һ����ͬ����Ȼ�ϣ�����Va+Vb=100mL��Va��Vb����ҺpH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
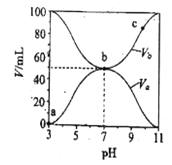
A. Ka(HA)=1��10-6mol/L
B. b��c (B+)=c(A-)=c(OH-)=c(H+)
C. c��ʱ��![]() ���¶����߶���С
���¶����߶���С
D. a��c������ˮ�ĵ���̶�ʼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʢ����ˮ����֧�Թ��зֱ����ƾ������Ȼ�̼�ͱ������ã���������������ȷ�Ľ����ǣ�������

A. �ټ���CCl4 �ڼ��˱� �ۼ��˾ƾ�
B. �ټ��˱� �ڼ���CCl4 �ۼ��˾ƾ�
C. �ټ��˾ƾ� �ڼ���CCl4 �ۼ��˱�
D. �ټ��˱� �ڼ��˾ƾ� �ۼ���CCl4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com