
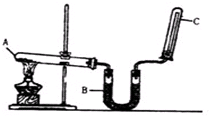
 实验室通常用如图所示的装置来制取干燥的氨气.回答下列问题:
实验室通常用如图所示的装置来制取干燥的氨气.回答下列问题:分析 (1)实验室用氯化铵固体和氢氧化钙固体反应制备氨气,二者反应生成氨气、氯化钙、水;
(2)氨气为碱性气体,应选择碱性干燥剂干燥;
(3)氨气其水溶液显碱性,能使湿润的红色石蕊试纸变蓝,能够使酚酞变红,氨气与浓盐酸反应冒白烟,据此解答;
(4)依据氨气极易溶于水的物理性质解答;
(5)在催化剂、高温高压条件下,氮气和氢气反应生成氨气;铵盐易和碱性物质反应生成氨气.
解答 解:(1)氯化铵固体和氢氧化钙固体反应的方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)氨气为碱性气体,应选择碱性干燥剂干燥,生石灰、碱石灰为碱性干燥剂,可以干燥氨气;浓氨气显碱性,不能用呈酸性的浓硫酸和五氧化二磷进行干燥;氨气能与氯化钙发生反应生成络合物(CaCl2•8NH3 ),因此也不能使用无水氯化钙来干燥氨气;
故答案为:AD;
(3)A.氨气通入酚酞溶液中发生反应NH3+H2O=NH3•H2O,NH3•H2O?NH4++OH-溶液呈碱性,酚酞溶液变红,该操作可以单纯检验氨气的存在,故A不选;
B.氨气溶于水得到氨水溶液,氨水显碱性,所以氨气能使湿润的红色石蕊试纸变蓝,可以用来检验氨气,故B不选;
C.浓硫酸是难挥发性的酸,氨气与蘸有浓H2SO4的玻璃棒靠近不会产生白烟,此操作不能用于检验氨气,故C选;
D.浓盐酸有挥发性,挥发出的分子会和氨气反应生成白色的烟,该操作可以检验氨气,故D不选;
故选:C;
(4)氨气极易溶于水,如果集气装置中有水,则氨气溶于水,得不到气体,所以收集氨气必须用干燥的集气装置;
故答案为:因为氨气极易溶于水;
(5)在催化剂、高温高压条件下,氮气和氢气反应生成氨气,反应方程式为3H2+N2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
故答案为:3H2+N2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
点评 本题考查了实验室氨气的制取,把握反应原理、实验现象、实验基本操作是解题关键,题目较简单,注意氨气检验方法的积累.


科目:高中化学 来源: 题型:解答题
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯是不饱和烃,乙烷是饱和烃 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,乙烷则不能 | |
| C. | 乙烯分子中存在碳碳双键,乙烷分子中存在碳碳单键,因此乙烯比乙烷稳定 | |
| D. | 乙烯分子为平面形结构,乙烷分子为立体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或反应 | 原理解释 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 合成氨反应需在高温条件下进行 | 该反应为吸热反应 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
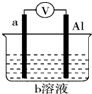 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com