
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |
科目:高中化学 来源: 题型:选择题
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | -571.6 kJ•mol-1,-2221.5kJ•mol-1 | |
| B. | -285.8 kJ•mol-1,-2013.8 kJ•mol-1 | |
| C. | -285.8 kJ•mol-1,-2221.5 kJ•mol-1 | |
| D. | -241.3 kJ•mol-1,-2013.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
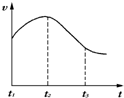 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
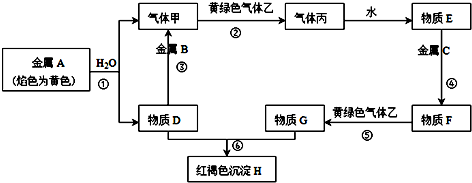
 、D
、D .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
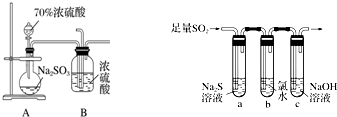
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 加入氯化钠溶液 | C. | 加入Na2CO3溶液 | D. | 加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水电离出的c(H+)=10-3mol/L | |
| B. | 溶液中c(A-)=10-3mol/L | |
| C. | 溶液中加水稀释,促进HA电离,溶液的c(H+)增大,但k不变 | |
| D. | 与0.1mol/LNaOH溶液等体积混合后所得溶液中(体积变化忽略不计)c(Na+)═c(A-)+c(OH-)-c(H+)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:填空题
前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
微粒 | EO2﹣ | EO3﹣ |
立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________.
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
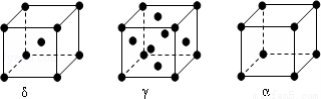
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________,δ、γ、α三种晶胞的边长之比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com