
如图是某泡腾片的标签。将这样一粒泡腾片放入水中,药片完全溶解,同时产生大量气泡。这个过程( )
泡腾片 |
每片含: 碳酸钙 500mg 维生素C 1000mg 柠檬酸 1350mg |
用量: |
用法: |
A.溶解了500mg的Ca2+
B.释放了112mL的气体
C.发生了反应:CO32- +2H+ = CO2↑+H2O
D.说明了柠檬酸的酸性比碳酸强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年宁夏高二上月考二化学卷(解析版) 题型:选择题
物质的量浓度相同的三种盐 NaX、NaY和NaZ的溶液,若它们的pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的排列顺序是 ( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷(解析版) 题型:选择题
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考三化学卷(解析版) 题型:填空题
研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
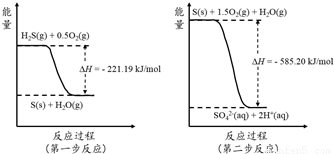
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g) 和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。
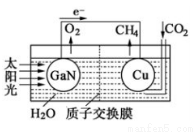
写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:实验题
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释
④检漏、 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 (保留一位小数),量取浓硫酸所用的量筒的规格是 (用下列编号填空)。
A.10ml | B.25ml | C.50ml | D.100ml |
(2)上述步骤中第③步的具体操作是
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①取浓硫酸后,洗涤量筒,洗涤液一并转移到烧杯中 ;
②烧杯中的溶液未冷却就转移到容量瓶中 ;
③量取浓硫酸时,俯视刻度线 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数,下列说法不正确的是( )
A、阿伏加德罗常数NA是0.012kg12 C中所含的原子 数
数
B、2g氢气所含氢原子数目为NA
C、标况下,22.4LNH3所含的分子数目为NA
D、1L 1 mo1·L-1NaCl溶液中所含有的Na+离子数目为NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
某无色溶液中加入BaCl2溶液生成不溶于稀硝酸的白色沉淀, 则溶液中含有的离子是( )
则溶液中含有的离子是( )
A.一定有 CO32- B.一定有Ag+ C.一定有SO42- D.无法肯定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高一上期中化学卷(解析版) 题型:实验题
为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置。(a、b为活塞,且每个装置中的溶液均过量。已知Na2SO3+H2SO4=Na2SO4+H2O+SO2↑)
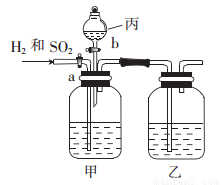
(1) 仪器丙的名称是____________。
(2) 甲容器中盛____________;乙容器中盛___________。(填字母)
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液
(3) 实验时关闭b,打开a,一段时间后甲中的溶质是__________。
(4) 当分离完一种气体后,关闭_________(填“a”或“b”,下同),打开_________,这样得到的气体是____________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:实验题
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
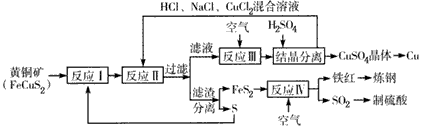
注:反应II的离子方程式为Cu2+ +CuS+4Cl- ═2[CuCl2]-+S↓
请回答下列问题;
(1)反应I的产物为 (填化学式)。
(2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均成酸性,相同条件下,同浓度的两种水溶液c(SO32-)较小的是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3 溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00Ml。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)反应IV所得气体中SO2的体积分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com