
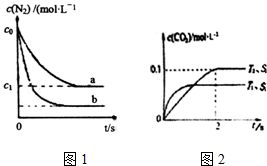
 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
分析 (1)a.依据氮气的浓度变化,找出三段式,计算平衡常数即可;
b.此容器为恒容密闭容器,ρ=$\frac{m}{V}$,据此判断即可;
c.若是充入NO,平衡逆向进行,氮气浓度增大;
d.由图可知,b曲线化学反应速率快,若是升高温度,氮气的平衡浓度减小,则正反应为吸热反应;
(2)①2s-3s内的平均反应速率v(NO)=$\frac{2.5mol/L-1.6mol/L}{3s-2s}$×10-4=9×10-5mol•L-1•S1,反应速率之比等于化学方程式计量数之比计算氮气的反应速率;
②计算出平衡时各物质的浓度,结合平衡常数表达式可计算平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
③根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时CO2的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时CO2的浓度相同,据此作图;
④能提高NO转化率则化学平衡正向移动,利用影响化学平衡移动的因素来分析;
(3)氮氧化物与氨气发生的反应是氧化还原反应,氮氧化物把氨气氧化为氮气,本身被还原为氮气,可以利用反应方程式通过设未知列方程组计算;也可以根据氧化还原反应的电子守恒计算;也可以利用平均值法计算.
解答 解:(1)a. N2(g)+O2(g)?2NO(g),
起(mol/L) c0 c0 0
转(mol/L) x x 2x
平(mol/L) c1 c1 2x
解2x=2(c0 -c1 ),故K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$,故a正确;
b.反应物和生成物均是气体,故气体的质量m不变,容器为恒容容器,故V不变,那么密度ρ=$\frac{m}{V}$不变,故b错误;
c.由图可知,b曲线氮气的平衡浓度减小,故应是平衡发生正向进行移动,若是充入NO平衡逆向进行,氮气浓度增大,故c错误;
d.由图可知,b曲线化学反应速率快(变化幅度大),氮气的平衡浓度减小,升高温度平衡正向移动,则正反应为吸热反应,即△H>0,故d正确,故选ad,
故答案为:ad;
(2)①2s-3s内的平均反应速率v(NO)=$\frac{2.5mol/L-1.6mol/L}{3s-2s}$×10-4=9×10-5mol•L-1•S1,v(N2)=$\frac{1}{2}$v(NO)=4.5×10-5mol•L-1•S1,
故答案为:4.5×10-5mol•L-1•S1;
②2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 4.5×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 4.5×10-4 9×10-4
K=$\frac{4.5×1{0}^{-4}×(9×1{0}^{-4})^{2}}{(1×1{0}^{-4})^{2}(2.7×1{0}^{-3})^{2}}$=5000,
故答案为:5000;
③温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时CO2的浓度相同,故c(CO2) 在T1、S2条件下达到平衡过程中的变化曲线为: ,
,
故答案为:<;温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0, ;
;
④降低反应体系温度,平衡正向移动,反应物转化率增大,缩小容器体积,增大压强,平衡正向移动,反应物转化率增大,
故答案为:降低反应体系的温度或缩小容器的体积;
(3)根据反应可知:氨气被氧化为氮气,NH3~N2~3e-;一氧化氮被还原为氮气,NO~N2~2e-二氧化氮被还原为氮气NO2~N2~4e-
设一氧化氮体积为x,二氧化氮体积为3-x,氨气的体积为3.5L,根据电子守恒可知:3.5L×3=2x+4×(3-x),
x=0.75L,二氧化氮体积为2.25L,则相同条件下,混合气体中NO和NO2的体积比等于物质的量之比=0.75:2.25=1:3;
故答案为:1:3.
点评 本题主要考查的是化学平衡建立的过程,涉及平衡常数的计算、平衡移动原理的应用、催化剂对平衡的影响、氧化还原反应单质守恒等,综合性较强,难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ba2+、HCO3-、NH4+、NO3- | ||
| C. | K+、Cu2+、Cl-、OH- | D. | Na+、CO32-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1mol•L-1NaClO溶液中:Na+、K+、I-、NO3- | |
| D. | 0.1mol•L-1FeCl3溶液中:NH4+、SCN-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为AgS | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应的还原剂是H2S | D. | 每生成1mo1X转移2mo1电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该消毒液的pH约为13:ClO-+H2O?HClO+OH- | |
| B. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、O2混合气体和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | NO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com