
(12��)(1)�����Ṥҵ�����У��ҹ����û�����Ϊԭ�� ����SO2����Ӧ�Ļ�ѧ����ʽΪ�� ���÷�Ӧ�� �н��С�
(2)Ϊ��������SO2��ת��ΪSO3�����ܳ���������ܣ��� �� �˶����������Ƚ������ĽӴ���(��ͼ)�������ܱ���ϵ�������������C������������Ϊ ��A��B��C����������¶��ɸߵ��͵�˳��Ϊ ��
(3)������������ ����SO3�����������ϲ������������ٴ�ͨ�� �����еڶ����������ٽ���һ�����պ�β���к��ٵ�SO2�������գ��Է���Ⱦ������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ������У�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(12��)��ͼ��Ԫ�����ڱ��е�һ���֡�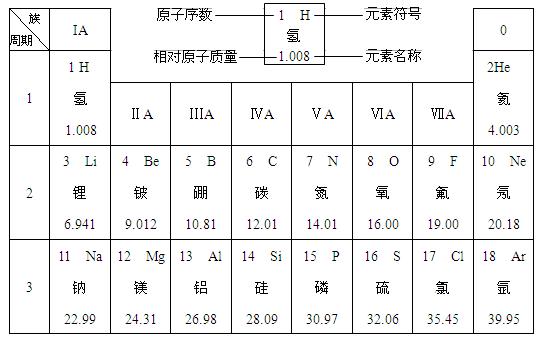
��Ԫ�����ڱ��У�ͬһ����(����)�е�Ԫ�أ���0��(��������)Ԫ���⣬������ԭ�������������࣬ԭ�Ӱ뾶��С���ڻ�ѧ��Ӧ�У�ԭ��ʧ���������������õ�����������ǿ��
��ش�
��1��������ԭ������Ϊ����������ԭ������Ϊ8��Ԫ��λ��Ԫ�����ڱ��ĵ��������ڣ�Ԫ�ط���Ϊ��������������������������(��������ǽ�����)Ԫ�ء�
��2��ԭ�Ӱ뾶��������þ(�����������������ͬ)��ԭ�ӵõ����������������ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������У�߶���ѧ��ѡ����ĩ��ѧ�Ծ��������棩 ���ͣ�ʵ����
(��12��)������������Ҫ������������ԭ��������ˮ��Һ�ֳ�Ϊ˫��ˮ��������������ɱ����Ư�ȡ�ij��ѧ��ȤС��ȡһ�����Ĺ���������Һ��ȷ�ⶨ�˹��������Ũ�ȣ� ����д���пհף�
��1����10.00 mL����������Һ��250mL ___________(����������)�У���ˮϡ�����̶ȣ�ҡ�ȡ���ȡϡ�ͺ�Ĺ���������Һ25.00mL����ƿ�У�����ϡ�����ữ��������ˮϡ�ͣ�������������
��2���ø�����ر���Һ�ζ������������䷴Ӧ�����ӷ���ʽ���£��뽫������ʵĻ�ѧ�������ͻ�ѧʽ�ֱ��������к��ߺ������ڡ�
MnO4- + H2O2 + H+ == Mn2+ + O2 + ( )
��3����ȡ10mL����������Һ������_________________(���ʽ����ʽ��)�ζ��ܡ����ü�ʽ�ζ���ʢװKMnO4��Һ��ԭ���� ���ζ������յ��������__________ _____________��
��4���ظ��ζ����Σ�ƽ������c mol/L KMnO4����ҺV mL����ԭ����������Һ�й��������Ũ��Ϊ_________________________________��
��5����ʢװ������ر���Һ�ĵζ���������ˮϴ��û���ñ�Һ��ϴ����ⶨ���_________(�ƫ�ߡ���ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ĵ�ʡ�˱��и�����һ������Բ��Ի�ѧ�Ծ��������棩 ���ͣ������
(12��)��ҵ������ʱ�����ýӴ�������Ӧ��SO2ת��ΪSO3��һ���ؼ��IJ��衣
(1)�ڽӴ�����2SO2(g)+O2(g)
 2SO3(g)�ﵽƽ��״̬�ı�־��______��
2SO3(g)�ﵽƽ��״̬�ı�־��______��
A����(O2)��=2��(SO2)��
B�����������������������ʱ����仯
C���������������ɫ����ʱ����仯
D�������������ѹǿ����ʱ����仯
(2)���й��ڷ�Ӧ2SO2(g)+O2(g)
 2SO3(g)
��H<0������ͼ���в���ȷ����______ (����ĸ��ţ���
2SO3(g)
��H<0������ͼ���в���ȷ����______ (����ĸ��ţ���

(3)ij�¶���SO2(g)+ 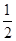 O2(g)
O2(g)
 SO3(g)
��H=-98KJ/mol
SO3(g)
��H=-98KJ/mol
�ٿ�ʼʱ������̶����ܱ������м���4mol SO2 (g)��1mol O2 (g)���ﵽƽ��ʱ ���ų�196 KJ�����������¶���SO2��ƽ��ת����Ϊ______
����֪��̬�������ȼ����Ϊ296KJ/mol������S(s)����2 molSO3(g)�Ħ�HΪ____________
(4)����SO42-����BaCl2��Һ������ʱ��BaSO4��Ksp=1.08��10-10���ֽ�������� BaCl2��Һ��2.0��10��3mol/L��H2SO4��Һ��ϡ���Ҫ����BaSO4������ԭBaCl2��Һ����СŨ��Ϊ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��㶫ʡ��ͷ�и߶�10���¿���ѧ�Ծ��������棩 ���ͣ������
(12��)д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1����H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ����֪��
Cu��s��+2H+��aq��=Cu2+��aq��+H2��g�� ��H=+64.39kJ/mol
2H2O2��l��=2H2O��l��+O2��g�� ��H=��196.46kJ/mol
H2��g��+1/2 O2��g��=H2O��l�� ��H=��285.84kJ/mol
��H2SO4��Һ��Cu��H2O2��Ӧ����Cu2+��H2O���Ȼ�ѧ����ʽΪ ��
��2����298K�£�C��Al�ĵ��ʸ�1mol��ȫȼ�գ��ֱ�ų�����aKJ��bKJ����֪һ�������£�Al�ܽ�C��CO2�û�������д�����û���Ӧ���Ȼ�ѧ����ʽ
��3��25�棬1.01��105Pa�£�1g ����������г��ȼ�շų� 9.36kJ������д����ʾ��ȼ���ȵ��Ȼ�ѧ����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ��ͨ��ͨ��������4�²�©��ȱר���⻯ѧ�Ծ��������棩 ���ͣ�������
(12��)�Ȼ�������SO2Cl2����Ҫ�����Ȼ���������һ����ɫҺ�壬�۵㡪54.1�棬�е�69.1�棬��ˮ����������Ȼ��⡣�Ȼ��������ø���Ķ�������������ڻ���̿���������·�Ӧ��ȡ��SO2(g)��Cl2(g) SO2Cl2(l)
��H����97.3kJ/mol
SO2Cl2(l)
��H����97.3kJ/mol
��Ϊ�����������Ӧ��Cl2��ƽ��ת���ʣ����д�ʩ�������� ���ñ����գ���
A����С������� B��ʹ�ô��� C������SO2Ũ�� D�������¶�
(2)300��ʱ�����Ϊ1 L���ܱ������г���16.20 g SO2Cl2���ﵽƽ��ʱ�����к�SO2 7.616 g����300��ʱ�ϳ�SO2Cl2��Ӧ��ƽ�ⳣ��Ϊ ��
(3)��֪ij�¶��£���֪Ksp(AgCl)��2.0��10��10��Ksp(Ag2SO4)��1.6��10��5����SO2Cl2����ˮ������Һ����μ���AgNO3ϡ��Һ����Ag+Ũ��Ϊ0.1mol/Lʱ������Һ��Cl-Ũ����SO42- Ũ��֮��Ϊ ��
�Ƚ�(2)���õ�ƽ����������������BaCl2��Һ�У������������ɳ����������Ƕ��٣�д��������̣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com