
 NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分)
NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分) NH4 ++OH-;
NH4 ++OH-; | | 电解质 | 非电解质 |
| 相同点 | 均为化合物 | |
| 不同点 | 水溶液或熔融状态能导电 | 水溶液和熔融状态都不能导电 |
| 本质区别 | 在水溶液里或熔融状态下自身能发生电离 | 在水溶液里或熔融状态下自身不能发生电离 |
| 所含物质类型 | 酸, 碱, 盐 , 活泼金属氧化物,水 | 非金属氧化物,非酸性气态化合物,部分有机物 |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:不详 题型:单选题
| | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
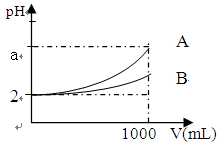
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a2 = a3<a4<a1 | B.a3 = a2<a1<a4 |
| C.a2<a3<a1<a4 | D.a1<a2<a3<a4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 醋酸溶液加水稀释,下列说法正确的是()
醋酸溶液加水稀释,下列说法正确的是()| A.溶液中c(H+)和c(OH-)都减小 | B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 | D.溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35.5∶108 | B.71∶2 | C.108∶35.5 | D.71∶109 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
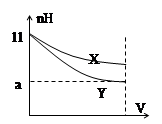
| A.X、Y两种碱的物质的量浓度一定相等 |
| B.稀释后,X溶液碱性比Y溶液碱性强 |
| C.若9<a<11,则X、Y都是弱碱 |
| D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积V(X)>V(Y) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a的浓度必小于乙酸的浓度 | B.a的浓度必大于乙酸的浓度 |
| C.b的浓度必小于乙酸的浓度 | D.b的浓度必大于乙酸的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com