
| 产率 | 75% | 65% | 88% | 72% |
| 教师对产率的评价 | 偏低 | 偏低 | 偏高 | 偏低 |
| A. | 第1组:过滤时滤纸有气泡 | |
| B. | 第2组:没有蒸发干,精盐中仍然有水分 | |
| C. | 第3组:过滤时滤液高于滤纸的边缘 | |
| D. | 第4组:滤液中还有少量泥沙就开始蒸发 |
分析 A.滤纸有气泡影响过滤速度;
B.精盐中仍然有水分,导致测定食盐质量偏大;
C.过滤时滤液高于滤纸的边缘,精盐中含有含有不溶性杂质;
D.滤液中还有少量泥沙就开始蒸发,食盐中含有泥沙.
解答 解:A.滤纸有气泡会使过滤变慢,影响过滤速度,不影响精盐质量,故A不符合;
B.精盐中仍然有水分,水分的质量计算在食盐质量中,导致测定食盐质量偏大,产率偏高,故B不符合;
C.过滤时滤液高于滤纸的边缘,部分滤液没有通过过滤,而直接从滤纸与漏斗之间流下,精盐中含有含有不溶性杂质,产率偏高,故C符号;
D.滤液中还有少量泥沙就开始蒸发,食盐中含有泥沙,产率偏高,故D不符合.
故选:C.
点评 本题考查粗盐提纯、误差分析,注意掌握粗盐提纯的原理、过滤操作的注意事项(“一贴、二低、三靠”)、蒸发操作的注意事项等.


科目:高中化学 来源: 题型:选择题
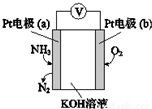
| A. | 该传感器在工作过程中KOH的物质的量不变 | |
| B. | a极的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | b极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s,单斜)═S(s,正交)△H3=+0.33 kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.48L3717Cl2含有0.72NA个中子 | |
| B. | 3717Cl、3517Cl互为同位素,3717Cl2、3517Cl2互为同素异形体 | |
| C. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| D. | 3717Cl2的摩尔质量是74 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们对苯及芳香烃的认识有一个不断深化的过程.
人们对苯及芳香烃的认识有一个不断深化的过程. :该结构的一氯代物有1种.
:该结构的一氯代物有1种. ,下列关于萘的说法正确的是CD(填编号)
,下列关于萘的说法正确的是CD(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 制备收集CO2:连接b→d→e | B. | 制备收集H2:连接b→c→g | ||
| C. | 制备收集NH3:连接b→d→e→c | D. | 制备收集Cl2:连接a→f→c→e→d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
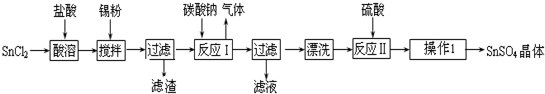
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com