
(1)ʵ������ȡ����Ļ�ѧ����ʽ____________________________________��
(2)����װ��ͼ����������⡣

����ȡ��������ķ���װ�ÿ���ѡ��_____________��
������Cװ���ռ��������壬������ӦΪ_____________��ԭ����___________________��
��Ϊ����֤�����ˮ��Һ�����ԣ����Խ�����ͨ��װ��D��D����ʢ���Լ�Ӧ����_____________��������_______________________��
��������ʵ��ʱ��Ϊ�˷�ֹ����������ݳ���Ⱦ���������Խ���ͨ��װ��E���գ�E��©��������Ϊ____________________________��
������װ�õ����ӿ�����˳��Ϊ(��дa��b��c�ȷ���)____________________��
(3)����
���ռ�����H2S��������(��״��)��
����Һ��Fe2+��H+�����ʵ���Ũ�ȡ�
������(1)(2)�ԡ�(3)����FeS+2H+![]() Fe2++H2S������֪HCl������Ӧ��FeS�������㡣
Fe2++H2S������֪HCl������Ӧ��FeS�������㡣
![]()
������H2SΪ0.10 mol������Һ���ܽ��H2SΪ��n(H2S)=0.10 mol��L-1��
������Fe2+Ϊ0.10 mol��Ũ��Ϊ��![]() =0.50 mol��L-1������H+ 0.20 mol����Ӧǰn(H+)=
=0.50 mol��L-1������H+ 0.20 mol����Ӧǰn(H+)=![]() =1.0 mol��L-1��
=1.0 mol��L-1��
�𰸣�(1)FeS+H2SO4![]() FeSO4+H2S��
FeSO4+H2S��
(2)��B ��b H2S���ܶȴ��ڿ������ܶ� ����ɫʯ����Һ ��Һ��� �ܷ�ֹ�ձ����Һ�嵹�� ��dbaefh
(3)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �����йط�Ӧ���£�
�����йط�Ӧ���£�| c2(NO2) |
| C2(NO)c(O2) |
| c2(NO2) |
| C2(NO)c(O2) |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ��ɽ�и�������ĩͳһ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����(H2S)��һ���ж��Ŀ�ȼ�����壬��H2S��������KOH��Һ�������ȼ�ϵ�أ����ܷ�ӦʽΪ2H2S+3O2+4KOH=2K2SO3+4H2O��
��1���õ�ع���ʱ����Ӧͨ�� ��
��2���õ�صĸ����缫��ӦʽΪ�� ��
��3���õ�ع���ʱ��������Һ��pH ������ߡ������䡱�����͡���
��4���������K2SO3�ɱ�����ΪK2SO4����������缫��Ӧʽ�е�K2SO3ӦΪK2SO4��ijѧϰС��������ع���һ��ʱ���ĵ������Һȡ�����飬��ȷ����ع���ʱ��Ӧ�IJ��ʵ�����������Լ���ѡ�ã��������С�����ʵ�鷽����ơ�
0.01mol��L��1KMnO4������Һ��1mol��L��1HNO3��1mol��L��1H2SO4��1mol��L��1HCl��
0.1mol��L��1Ba(OH)2��0.1 mol��L��1 BaCl2��
|
|
ʵ�鲽�� |
ʵ��������ؽ��� |
|
�� |
ȡ�����������Һ���Թ��У���pH��ֽ����pH�� |
��ֽ������ɫ�����ȶ���Һ��pHԼΪ14��˵����Һ���в����KOH�� |
|
�� |
�������� ��Һ���ټ��� ��Һ���� |
���а�ɫ��������������Һ�к���K2SO4�� ���ް�ɫ��������������Һ��û��K2SO4�� |
|
�� |
��ȡ�����������Һ���Թ��У��ȼ� 1 mol��L��1��H2SO4�ữ���ٵ���2~3��0.01 mol��L��1KMnO4������Һ���� |
��
�� |
��5������ؿ�ʼ����ʱÿ100mL�������Һ��KOH56g��ȡ��ع���һ��ʱ���ĵ������Һ20.00mL������BaCl2��Һ��������ȫ������ϴ�ӳ������������ڿ����г�ּ��������أ���ù�������Ϊ11.65g�������ع���һ��ʱ�����Һ��KOH�����ʵ���Ũ�� �� (���������λ��Ч���֣�������Һ������ֲ��䣬��֪��M(KOH)=56��M(BaSO4)=233��M(BaSO3)=217)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
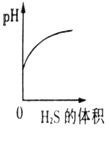
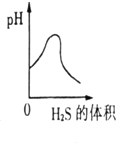
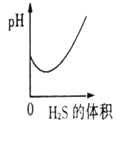
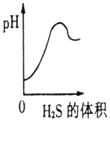
������������1��40�������ˮ��������������Ҫ���壬��ˮ��Һ��������(H2SO3 )������(H2S)��һ�־��г�������ζ�ľ綾���壬1��2.6�������ˮ����ˮ��Һ�������ᡣ��֪��ͬ�������£���������������������ᡣ�����������͵���������Һ��ͨ�˹������������壬��Ӧ�Ļ�ѧ����ʽΪ��2H2S + H2SO3 == 3S�� + 3H2O������ͼ����Һ��pH��ͨ����������ı仯����ʾ��ͼ��ȷ���� ( )

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com