
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H10O2的酯 | 10 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C8H10的芳香烃 | 4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5;
B.能使溴的四氯化碳溶液褪色,说明为戊烯;
C.能与Na反应生成氢气,说明为醇类,依据丁基的个数判断;
D.分子式为C8H10的芳香烃可为乙苯或二甲苯.
解答 解:A.若为甲酸和丁醇酯化,丁醇有4种,形成的酯有四个:
HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;
若为乙酸和丙醇酯化,丙醇有2种,形成的酯有2个:CH3COOCH2CH2CH3、CH3COOCH(CH3)2;
若为丙酸和乙醇酯化,丙酸有1种,形成的酯有1个:CH3CH2COOCH2CH3;
若为丁酸和甲醇酯化,丁酸有2中,形成的酯有2个:CH3CH2CH2COOCH3、(CH3)2CHCOOCH3.
故有9种,故A错误;
B.能使溴的四氯化碳溶液褪色,说明为戊烯,分别为1-戊烯、2-戊烯、2-甲基-1-丁烯、2-甲基-2-丁烯、3-甲基-1-丁烯,故总共有5种,故B正确;
C.能与Na反应生成氢气,说明为醇类,C4H10O可写成C4H9OH,丁基的个数为4,故总共应有4种醇,故C正确;
D.分子式为C8H10的芳香烃可为乙苯或二甲苯,二甲苯有邻、间、对3种同分异构体,共4种,故D正确.
故选A.
点评 本题主要考查的是同分异构体数目的判断,为高频考点,侧重考查学生的分析能力,掌握碳原子数小于5的烷烃基的个数是解决本题的关键,难度不大,甲基和乙基各1个,丙基2个,丁基4个,戊基8个,答题时注意思维要缜密,避免漏写的情况.


科目:高中化学 来源: 题型:推断题
| 元素 | 元素的相关信息 |
| A | A元素存在多种同素异形体,其中一种常用电极导电材料 |
| B | 短同期中金属性最强 |
| C | 单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
| E | 地壳中含量最多的金属 |
 ,含有的化学键类型为共价键;
,含有的化学键类型为共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数为6 | B. | 该配合物可能是平面正方形结构 | ||
| C. | Cl-和NH3分子均与Pt4+形成配位 | D. | 该配合物的配体只有NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
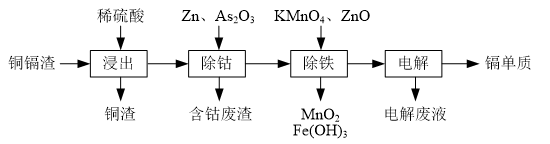
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片做阴极,石墨做阳极 | |
| B. | 白色沉淀在阴极附近生成 | |
| C. | 阳极区溶液变蓝的原因是:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 | |
| D. | 阳极区溶液变蓝的原因是:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l) | |
| B. | 4Al(s)+3O2(g)═2Al2O3(s) | |
| C. | 2Na(s)+2H2O(l)═2Na+(aq)+2OH- (aq)+H2(g) | |
| D. | 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH- (aq)═BaSO4(s)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其化学键属极性共价键(填“极性”或“非极性”).
,其化学键属极性共价键(填“极性”或“非极性”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com