
分析 除杂时要除去杂质且不能引进新的杂质,
①MgO和NaOH不反应,Al2O3和NaOH溶液反应生成可溶性的NaAlO2,然后采用过滤方法除去杂质;
②加热条件下Na2CO3不分解,NaHCO3分解生成Na2CO3和CO2、H2O,所以采用加热方法即可除杂.
解答 解:除杂时要除去杂质且不能引进新的杂质,
①MgO和NaOH不反应,Al2O3和NaOH溶液反应生成可溶性的NaAlO2,然后采用过滤方法除去杂质,
反应方程式为2NaOH+Al2O3=2NaAlO2+H2O;
②加热条件下Na2CO3不分解,NaHCO3分解生成Na2CO3和CO2、H2O,所以采用加热方法即可除杂,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaOH+Al2O3=2NaAlO2+H2O; 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 本题以物质的分离和提纯为载体考查化学方程式的书写,明确物质差异性是解本题关键,注意:除杂时不能引进新的杂质且操作简单,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA(注:粗铜含有Zn、Fe等杂质) | |
| B. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| C. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| D. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
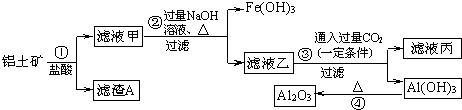
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 模拟对象 | 类推结论 | |
| A | 2HCl+Mg═MgCl2+H2↑ | H2SO4+2Na═Na2SO4+H2↑ |
| B | Cl2+2Fe2+═2 Fe3++2Cl- | I2+2Fe2+═2Fe3++2I- |
| C | Mg在O2中燃烧生成MgO | Na在O2中燃烧生成Na2O |
| D | Al在NaOH溶液中反应可产生H2 | Mg与NaOH溶液反应也可以产生H2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
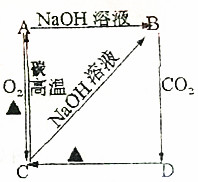 根据如图所示变化关系,请回答下列问题.
根据如图所示变化关系,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是CO2 | B. | 一定是SO2 | ||
| C. | 可能是CO2或SO2 | D. | 一定是CO2和SO2混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液中:NH4+、Ca2+、Cl-、K+ | |
| B. | Kw/c(OH-)=1.0mol•L-1的溶液中:Mg2+、NO3、NH4+、I- | |
| C. | 中性溶液中:K+、Cl-、Na+、CO32- | |
| D. | 无色溶液中:Fe3+、Cl-、Na+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | |
| Z | W |
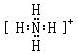 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烃 | B. | 分子式为C4H10O的醇 | ||
| C. | 分子式为C4H8的烯烃 | D. | 分子式为C3H6O2的酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com