
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |


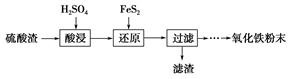
科目:高中化学 来源:不详 题型:填空题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
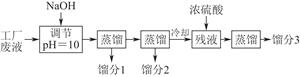
科目:高中化学 来源:不详 题型:单选题
| A.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中生成碳酸钠 |
| C.检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热 |
| D.在浓度均为0.01 mol·L-1的NaCl和Na2CrO4溶液中滴加0.01 mol·L-1AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2 | B.H2SO4 | C.NaOH | D.AgNO3 |
查看答案和解析>>
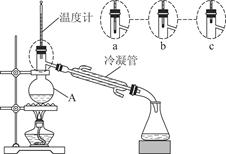
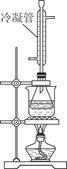
科目:高中化学 来源:不详 题型:实验题
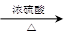 CH3CH2CHCH2↑+H2O
CH3CH2CHCH2↑+H2O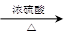 (n?C4H9)2O+H2O
(n?C4H9)2O+H2O| A.减少HBr的挥发 |
| B.防止正丁醇的挥发 |
| C.防止溴化钠被氧化 |
| D.防止温度过高导致炭化结焦 |
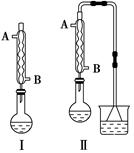
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
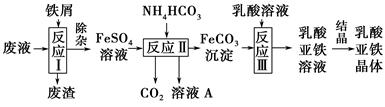
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
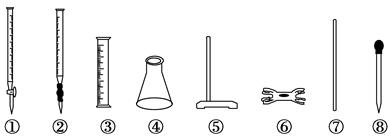
| A.①④⑤⑥ | B.②③⑦⑧ | C.②④⑤⑥ | D.④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
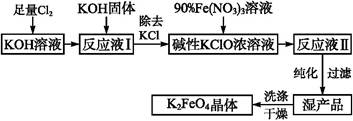
 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低) 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高) 2K2FeO4+6KNO3+3KCl+5H2O
2K2FeO4+6KNO3+3KCl+5H2O ;② 。
;② 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.萃取分液法 | B.加热法 | C.结晶法 | D.分液法 E.过滤法 F.蒸馏法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com