(1)工业上以粗铜为原料采取如图甲所示流程制备硝酸铜晶体.
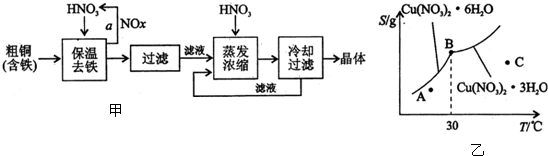
①在步骤a中,还需要通入氧气和水,其目的是将NO
x氧化成HNO
3;现有1L NO
2、N0混合气体NO
x,将其氧化成HNO
3,需同温同压下O
2的体积0.6L,则混和气体中N0
2、N0的物质量之比为
②在保温去铁的过程中,为使Fe
3+沉淀完全,可以向溶液中加入CuO调节溶液的pH.根.据下表数据,溶液的PH应保持在
的范围内.
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
③进行蒸发浓缩时,要用硝酸调节溶液的PH=1,其目的是
(结合离子方程式说明).
(2)图乙是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO
3)
2?nH
20]的溶解度曲线(温度在30
0C前后对应不同的晶体),下列说法不正确的是
(填字母).
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO
3)
2?3H
20
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO
3)
2 6H
2O 晶体
(3)氨气是工业上合成硝酸的原料,科学家采用高质子导电性的SCY陶瓷(能传递H
+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N
2+3H
22NH
3,则在电化学合成氨的过程中,阴极电极反应式为
;一定温度下,按照一定的比例通入N
2和H
2合成NH
3,达到平衡时,n(N
2):n(H
2):n(NH
3)=2:3:6.缩小体积,反应再次达到平衡时n(H
2)=1mol,n(NH
3)=1Omol,则该反应中通入N
2的物质的量是
;已知该反应放出462KJ的热量,在此条件下合成氨的热化学方程式是
.




 阅读快车系列答案
阅读快车系列答案
 如图所示是电解氯化钠溶液(含酚酞)的装置.有毒气体收集的装置省略没有画出,两电极均是惰性电极.
如图所示是电解氯化钠溶液(含酚酞)的装置.有毒气体收集的装置省略没有画出,两电极均是惰性电极.
 碳、氮、氧、铜是与人类生产三生活息息相关的化学元素,请回答下列问题:
碳、氮、氧、铜是与人类生产三生活息息相关的化学元素,请回答下列问题: