
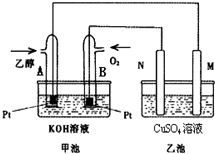
 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.分析 (1)根据燃烧热的概念来判断;
(2)根据盖斯定律来写热化学方程式;
(3)甲池是燃料电池中,通氧气的极是正极,该极上发生氧气得电子的还原反应,所以总反应方程式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O;
(4)根据乙池中两电极的电极反应计算两电极产生的气体体积恰好相等时转移的电子数,进而确定消耗乙醇的量.
解答 解:(1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,而H2O的稳定化合物是液态水,H2O蒸汽转变为液态水需要放热,所以CH3OH的燃烧热大于192.9kJ/mol,故答案为:大于;
(2)CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol ①
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol ②
②-①得 3H2(g)+3/2O2(g)=3H2O(g)△H=-241.9kJ/mol ③
H2O(l)=H2O(g)△H=+44kJ/mol ④
③-④×3 得 3H2(g)+3/2O2(g)=3H2O(g)△H=-373.9kJ/mol 即H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol;
(3)甲池是燃料电池中,通氧气的极是正极,该极上发生氧气得电子的还原反应,所以总反应方程式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O,故答案为:C2H5OH+3O2+4KOH=2K2CO3+5H2O;
(4)乙池中阳极反应是4OH--4e-═O2↑+2H2O,阴极反应依次是:Cu2++2e-═Cu,2H++2e-═H2,
当铜离子全部放电时,转移电子是0.6mol,
设转移nmol电子时,两极上产生气体的体积相等,
则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),
解得n=1.2,
根据反应C2H6O+3O2═2CO2+3H2O,在转移12mol电子时,消耗C2H6O的量为1mol,当转移1.2mol电子时,理论上消耗乙醇0.1moL,
故答案为:0.1.
点评 本题是一道关于电化学和热化学知识的综合考查题,要求学生注意知识的灵活应用,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Zn粒与稀HCl反应制H2 | B. | 用大理石与稀HCl反应制CO2 | ||
| C. | 用Cu与稀HNO3反应制NO | D. | 用MnO2与浓HCl反应制Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 久置的氯水中已没有分子,只有离子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| B. | 蒸发到析出晶体时才需要用玻璃棒搅拌 | |
| C. | 待溶液蒸干后即停止加热 | |
| D. | 当蒸发皿中出现较多晶体时就应停止加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com