(2010?海淀区二模)近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.
(1)汽车内燃机工作时引起反应:N
2(g)+O
2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.
①该反应的平衡常数的表达式为K=
.
②T℃时,向容积为2L的密闭容器中充入10mol N
2与5mol O
2,2min后达到平衡,此时NO的物质的量为2mol,则O
2的化学反应速率为
0.25mol/(L?min)
0.25mol/(L?min)
.
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示.(已知:T
1<T
2)
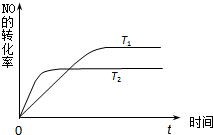
①由此推知,反应 N
2(g)+O
2(g)?2NO(g)为(填“吸热”或“放热”)
放热
放热
反应.
②一定温度下,能够说明反应 N
2(g)+O
2(g)?2NO(g) 已达到平衡的是(填序号)
bc
bc
.
a.容器内的压强不发生变化 b.NO生成的速率和NO分解的速率相等
c.NO、N
2、O
2的浓度保持不变 d.单位时间内生成4mol NO,同时消耗2mol N
2(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用C
xH
y(烃)催化还原NO
x消除氮氧化物的污染.
已知:CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H
1=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H
2CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g)△H
3=-867kJ?mol
-1则△H
2=
-1160kJ?mol-1
-1160kJ?mol-1
.
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为
2NOx+2xCO═2xCO2+N2
2NOx+2xCO═2xCO2+N2
.

 ①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)
①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”) 2NO(g),利用平衡三部曲求出,各物质的物质的量,再利用反应速率公式计算;
2NO(g),利用平衡三部曲求出,各物质的物质的量,再利用反应速率公式计算; 2NO(g),
2NO(g),

 (2010?海淀区二模)石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳质新材料,是构建富勒烯、纳米碳管的基本单元,有广泛的用途.下列说法正确的是( )
(2010?海淀区二模)石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳质新材料,是构建富勒烯、纳米碳管的基本单元,有广泛的用途.下列说法正确的是( )