
分析 等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸盐,C为硫酸盐;等物质的量混合,生成沉淀可能为硫酸钡,则A为NH4Cl,B为Ba(NO3)2,C为Fe2(SO4)3,以此来解答.
解答 解:等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸盐,C为硫酸盐;等物质的量混合,生成沉淀可能为硫酸钡,则A为NH4Cl,B为Ba(NO3)2,C为Fe2(SO4)3,
(1)白色沉淀为硫酸钡,则三种盐中还含有Ba2+,故答案为:B;
(2)由上述分析可知,C为Fe2(SO4)3,故答案为:Fe2(SO4)3;
(3)Fe3+、Cl-、NO3-、NH4+四种离子且物质的量之比依次为1:1:3:1,设NH4Cl为1mol,则Ba(NO3)2为1.5mol,Fe2(SO4)3为0.5mol,A、B、C三种正盐的物质的量之比为2:3:1,若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,硝酸钡与二氧化硫发生氧化还原反应生成BaSO4沉淀和NO气体,
故答案为:2:3:1;硫酸钡(或BaSO4).
点评 本题考查无机物的推断,为高频考点,把握等物质的量混合时硫酸根离子剩余推断C为硫酸铁为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识及氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
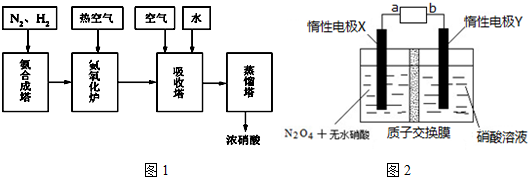
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
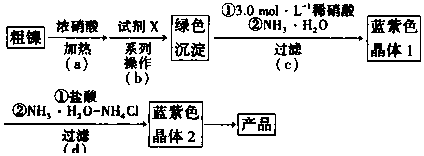
| Fe3+ | Cr3+ | Ni2+ | |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
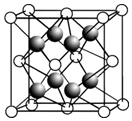 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | KOH溶液的 浓度/mol•L-1 | 滴定完成时,KOH溶液滴入的体积/mL | 待测盐的体积/mL酸 |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com