
| A. | CH3-CH2-CH3 | B. | CH2=CHCH2CH3 | C. | CH3C=CCH2CH3 | D. | 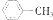 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断.
解答 解:A.共有3个碳原子,处于同一平面上,故A正确;
B.CH2=CHCH2CH3中与C=C直接相连的原子公平面,甲基不直接连在碳碳双键上,则不一定处于同一平面上,故B错误;
C.CH3C=CCH2CH3中与C=C直接相连的原子公平面,甲基不直接连在碳碳双键上,则不一定处于同一平面上,故C错误;
D.苯为平面结构,甲苯中甲基碳原子处于苯中H原子位置,所有碳原子都处在同一平面上,故D正确.
故选AD.
点评 本题主要考查有机化合物的结构特点,难度不大,注意从甲烷、乙烯、苯和乙炔的结构特点判断分子中原子共面、共线问题,注意单键可以旋转.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ H+ SO42- | B. | H+ Ag+ NO3- | C. | K+ HCO3-Cl- | D. | Na+ NO3- Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化能的大小对化前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ.mol-1,则H2S04(aq)和Ba(0H)2(aq)反应的中 和热△H=2×(-57.3 )kJ•mol-1 | |
| D. | 因 N2(g)+3H2(g)?2NHs(g)△H=-dkJ.mol-1,故在某溶器中投入 l molN2与 3molH2充分反应后,放出热量小于dkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.05NA个溴分子的CCl4溶液可以和1.12L乙烯恰好完全反应 | |
| B. | 标准状况下,11.2L的氯气分子参加氧化还原反应,转移的电子数目不一定是NA个 | |
| C. | 将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积大约为22.4L | |
| D. | 16gCH4与19gH3O+所含有的质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
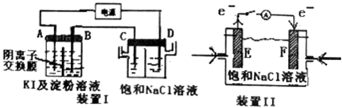 以下装置中,电极材料均为惰性电极.装置Ⅰ中,接通电源,发现A电极附近溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO${\;}_{3}^{-}$+5I-+3H2O.
以下装置中,电极材料均为惰性电极.装置Ⅰ中,接通电源,发现A电极附近溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO${\;}_{3}^{-}$+5I-+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉长期暴露在空气中最后会变质失效 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | PM2.5是对空气中直径小于或等于2.5微米(2.5×10-6m)的固体颗粒或液滴的总称,其分散在空气中一定形成气溶胶 | |
| D. | 氯气溶于水生成次氯酸有强氧化性,可以起净水和杀菌消毒的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com