
���� ��1����������һ�����ʵ���Ũ����Һ��һ�㲽��ѡ����Ҫ��������
��2������C=$\frac{1000�Ѧ�}{M}$����Ũ��������ʵ���Ũ�ȣ�����ϡ��ǰ�����ʵ����ʵ������������ҪŨ�������������C=$\frac{n}{V}$������������
��� �⣺��1������Ũ��Ϊ0.5mol•L-1��ϡ����500ml��һ�㲽��Ϊ�����㡢��ȡ��ϡ�͡���Һ��ϴ�ӡ����ݣ��õ�����������Ͳ���ձ�����������500mL����ƿ����ͷ�ιܣ����Ի�ȱ�ٵ�������500mL����ƿ����ͷ�ιܣ�
�ʴ�Ϊ��500mL����ƿ����ͷ�ιܣ�
��2����98%��Ũ���ᣨ��=1.84g•cm-3�������ʵ���Ũ��C=$\frac{1000��1.84��98%}{98}$=18.4mol/L������ҪŨ�������ΪV����������Һϡ���ɵã�V��18.4mol/L=0.5mol•L-1��500mL�����V=13.6mL��
�ʴ�Ϊ��13.6��
����Ͳ��ȡŨ���������Ͳ�ڱڻ��������ᣬ��ˮϴ����Ͳ��ϴҺһ��ת��������ƿ��������ȡ��Ũ�������ƫ�����ʵ����ʵ���ƫ����ҺŨ��ƫ�ߣ�
�ʴ�Ϊ��ƫ�ߣ�
���� ���⿼����һ�����ʵ���Ũ����Һ�����ƣ���ȷ����ԭ���Ͳ��������ǽ���ؼ���ע���������ķ����ͼ��ɣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2mol CH4 | B�� | 3mol NH3 | C�� | 4mol H3PO4 | D�� | 5mol H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
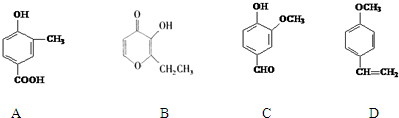
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��д��B������NaHCO3��Һ��ȫ��Ӧ�Ļ�ѧ����ʽ��
��д��B������NaHCO3��Һ��ȫ��Ӧ�Ļ�ѧ����ʽ��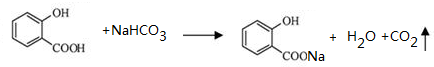 ��
�� ��
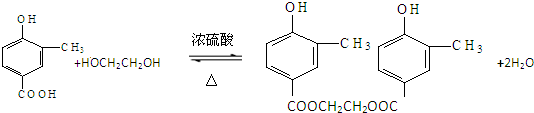
�� ����һ����Ҫ���л��ϳ��м��壮����ͼ����ʾ����Ϣ����д���Ա����ױ�Ϊԭ����ȡ�û�����ĺϳ�·������ͼ����ԭ����ѡ����
����һ����Ҫ���л��ϳ��м��壮����ͼ����ʾ����Ϣ����д���Ա����ױ�Ϊԭ����ȡ�û�����ĺϳ�·������ͼ����ԭ����ѡ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KClO3�TK++Cl-+3O2- | B�� | H2SO4�T2H++SO42- | ||
| C�� | Mg��NO3��2�TMg2++2NO3- | D�� | Na2SO4�T2Na++SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ͼ1���ڷų�������Ȼ�̼��Һ | |
| B�� | ͼ2����ʵ�����ռ�SO2 | |
| C�� | ͼ3����ʵ�����Ʊ�Fe��OH��2 | |
| D�� | ͼ4���ڱȽ�NaHCO3��Na2CO3���ȶ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��g����H=-1367.0 kJ/mol��ȼ���ȣ� | |
| B�� | NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l����H=+57.3kJ/mol���к��ȣ� | |
| C�� | 2NO2=O2+2NO��H=+116.2kJ/mol����Ӧ�ȣ� | |
| D�� | S��s��+O2��g���TSO2��g����H=-296.8kJ/mol����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X������F3O2�������л�ԭ�� | |
| B�� | X������OF2�������������� | |
| C�� | ��F2��NaOH��Ӧʱ��F2�������������ǻ�ԭ�� | |
| D�� | �ڷ�Ӧ�л���NaFO���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com