
分析 (1)0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成正盐,溶液呈碱性,说明NaA为强碱弱酸盐,弱酸根离子易水解;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(3)任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒计算;
(4)NH4A溶液为中性,则HA的电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性大于碳酸,即HA的电离程度大于碳酸电离程度;
(5)根据铵根离子的水解程度判断溶液酸碱性的大小,溶液浓度越稀,盐的水解程度越大;
(6)①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4 ⑤NH4HCO3 ,先不考虑水解,则②(NH4)2CO3和③(NH4)2SO4都含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,溶液中c(NH4+)根据盐类水解的影响分析判断.
解答 解:(1)0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成正盐,溶液呈碱性,说明NaA为强碱弱酸盐,弱酸根离子易水解而使其溶液呈碱性,水解离子方程式为:A-+H2O?ΗΑ+ΟΗ-,
故答案为:A-+H2O?ΗΑ+ΟΗ-;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,所以混合溶液中由水电离出的c(H+)>0.1mol/L NaOH溶液中由水电离出的c(H+),故答案为:>;
(3)溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),所以得c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,
溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),存在物料守恒得c(Na+)=c(A-)+c(HA)=0.05mol/L,c(OH-)-c(HA)=c(H+)=1×10-8mol/L,
故答案为:9.9×10-7;1×10-8;
(4)NH4A溶液为中性,则HA的电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性大于碳酸,即HA的电离程度大于碳酸电离程度,所以铵根离子水解程度小于碳酸根离子水解程度,所以碳酸铵溶液呈碱性,pH>7,
故答案为:>;
(5)(NH4)2SO4 和NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中铵根离子浓度越大,水解程度越小,但水解的个数多,所以氯化铵溶液的pH值大于硫酸铵;NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;
NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,所以溶液的pH值最大,则pH大小顺序为A>B>D>C,
故答案为:A>B>D>C;
(6)物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2CO3、③(NH4)2SO4、④NH4HSO4、⑤NH4HCO3;先不考虑水解,则②(NH4)2CO3 和 ③(NH4)2SO4 都含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,而②(NH4)2CO3 中NH4+水解显酸性,CO32-水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,③(NH4)2SO4中硫酸根离子对铵根离子浓度无影响,即溶液中c(NH4+)③>②;
①④⑤三种物质中,④NH4HSO4酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH4+)较大,
①NH4Cl,NH4+水解,④NH4HSO4,溶液中氢离子抑制铵根离子水解,即溶液中c(NH4+)④>①;
⑤NH4HCO3 ,HCO3- 水解促进铵根离子水解 溶液中c(NH4+)应最小,则①>⑤;
按c(NH4+)由大到小的顺序排列为:③>②>④>①>⑤,故选D,故答案为:D.
点评 本题考查了酸碱混合溶液定性判断,盐类水解的原理和应用,注意盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析离子浓度的大小比较是解答的关键,难点是(3)题计算,利用电荷守恒代换进行计算即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 元素 | B. | 单质 | C. | 原子 | D. | 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电解质 | Ka1 | Ka2 |
| H2S | 1.3×10-7 | 7.1×10-15 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(25℃) |
| CH3COOH | K1=1.7×10-5 |
| HClO | K1=3.0×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 如表提供的数据下:HClO、HCO3-、ClO-、CO32- | |
| B. | pH=3的溶液中:CO32-、Na+、SO42-、AlO2- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
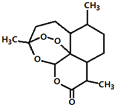 我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法不合理的是( )
我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法不合理的是( )| A. | 化学式为C15H22O5 | |
| B. | 能发生取代反应和氧化反应 | |
| C. | 在H2SO4或 NaOH溶液中均不能稳定存在 | |
| D. | 可用乙醇从青蒿浸取液中萃取出青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喷泉实验中用于收集氨气的烧瓶 | |
| B. | 中和滴定中用的滴定管 | |
| C. | 配制一定物质的量浓度溶液实验用的容量瓶 | |
| D. | 排水法收集氧气实验用的集气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氧化硫溶于水,溶液显酸性:SO3+H2O═H2SO3 | |
| B. | 用稀硫酸除去铁表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 漂白粉在空气中放置变质:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | |
| D. | 用盐酸除铜锈[Cu2(OH)2CO3]:Cu2(OH)2CO3+4H+═2Cu2++3H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com