
| A. | 20Ar | B. | 16O | C. | 18O | D. | 18O2- |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
 ;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给该反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 向反应体系中加入适量浓盐酸 | D. | 将铁片换成铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
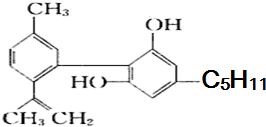 大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为:
大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为: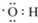 ,它与足量的溴水反应最多消耗Br23mol.
,它与足量的溴水反应最多消耗Br23mol.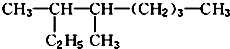 的名称是3,4-二甲基辛烷
的名称是3,4-二甲基辛烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
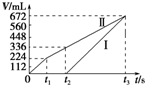 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO、NaH、N2 | |
| B. | SO2、N${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com