
(1)第一步,在分液漏斗中依次加入10 mL苯和5 mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深棕红色。
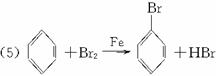
第二步,打开分液漏斗活塞,将苯、溴混合液按一定速率逐滴加入玻璃管甲中的铁丝上,观察到的现象是______________________________________________________。
从上述两步观察到的现象差异,可得出的结论是__________________________________。
(2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是________________________________________________;然后通过分液漏斗向U形管中加入适量的NaOH溶液,目的是__________。
(3)第四步,关闭胶皮管A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到溴苯的颜色是__________,它在U形管中液体的______________(填“上”或“下”)层。此步关闭管夹A和B的目的是______________________________________________________。
(4)要证明上述溴跟苯的反应是取代而不是加成反应,请根据装置乙的作用完成下列各题:
①小试管内的液体是__________(填名称),作用是______________________________。
②锥形瓶内的液体是__________(填名称),作用是______________________________。
③反应后,向锥形瓶内滴加试剂__________(填名称)溶液,作用是__________。此外,装置乙还能起到__________的作用。
(5)写出上述苯跟溴反应的化学方程式________________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
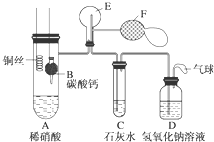 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:058
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(1)配平由Fe(NO3)2制取铁酸钠的化学方程式:
 Fe(NO3)2+
Fe(NO3)2+ NaOH+
NaOH+ Cl2
Cl2
 Na2FeO4+
Na2FeO4+ NaNO3+
NaNO3+ NaCl+
NaCl+ H2O
H2O
转移电子总数为________.
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是________.
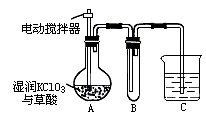
(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看作是亚氯酸和氯酸的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如下图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2凝聚装置,C为尾气吸收装置.请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充________装置.
②C中应装的试剂为________.
③在ClO2分子中的所有原子是否都满足最外层8电子结构________(填“是”或“否”).
(4)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2,Na2FeO4,Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是________>________>________.
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)A装置中锥形瓶内装的某正盐固体是 ,分液漏斗中装的试剂是_________。
(2)B装置中所盛装的试剂是 ,该试剂的作用是_________________________。
(3)装置C中出现的现象是_______________________。
(4)通过上述实验可证明三种酸的酸性强弱顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省陆丰市高一下学期第二次月考化学理科试卷(解析版) 题型:实验题
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球。

(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为
__________________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为______________________。
(3)装置E中开始时出现浅红棕色,原因是__________________________;用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是__________________________________。
(4)一段时间后,C中白色沉淀溶解,其原因是_________________________________;
。(用化学方程式表示)
(5)装置D的作用是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4,摩尔质量为166 g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理的新技术。ClO2和Na2FeO4在水处理过程中分别只被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率。那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是_____>________>__________。
(2)二氧化氯是一种黄绿色有刺激性气味的气体。其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸和氯酸的混合酸酐。工业上用湿润的KClO3和草酸在60℃时反应制得。某学生用如下图所示的装置模拟工业制取并收集ClO2,其中A为ClO2的发生装置,B为ClO2的收集装置,C为尾气吸收装置。请问: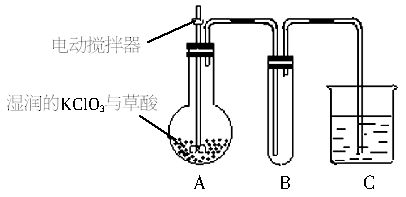
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置_________。
②C中应装的试剂为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com