

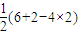 =4,且硫酸根离子中不含孤电子对,所以硫酸根离子呈正四面体构型,采用sp3杂化,氧原子的价电子排布图为
=4,且硫酸根离子中不含孤电子对,所以硫酸根离子呈正四面体构型,采用sp3杂化,氧原子的价电子排布图为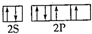 ,SO42-的等电子体有:ClO4- S2O32- PO43-,
,SO42-的等电子体有:ClO4- S2O32- PO43-,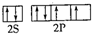 ;ClO4- S2O32- PO43-;
;ClO4- S2O32- PO43-; +1=2,O原子个数=2+4×
+1=2,O原子个数=2+4× =4,钛和氧原子个数之比=2:4=1:2,所以其化学式为:TiO2,故答案为:TiO2.
=4,钛和氧原子个数之比=2:4=1:2,所以其化学式为:TiO2,故答案为:TiO2.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门外国语学校高三模拟考试(理综)化学部分 题型:填空题
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前 20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三模拟考试(理综)化学部分 题型:填空题
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
|
A的最简单氢化物 |
B的最简单氢化物 |
M的最简单氢化物 |
X的氧化物 |
Y的最简单氢化物 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
分子呈正四面体构型 |
对应水化物为最强酸 |
回答下列问题
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com