
下列排列顺序正确的是:
A、半径:Al3+>Mg2+>Na+>F– B、稳定性:HI<HBr<HCl<HF
C、酸性:HClO4<H2SO4<H3PO4 D、碱性:Al(OH)3>Mg(OH)2>Ca(OH)2
科目:高中化学 来源: 题型:
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl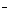 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为 ( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为 ( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
查看答案和解析>>
科目:高中化学 来源: 题型:
用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. c(NH3·H2O)/c(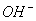 )
)
C. c(H+)和c(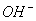 )的乘积 D. OH-的物质的量
)的乘积 D. OH-的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学键的下列叙述中,不正确的是
A、含有共价键的化合物一定是共价化合物
B、共价化合物中一定含有共价键
C、含有离子键的化合物一定是离子化合物
D、双原子单质分子中的共价键一定是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是A、B、C、D、E五种有机物的有关信息:
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为
|
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
A~E中,属于烃的是 (填字母)。
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 。
C催化氧化生成D的化学方程式为 。
有机物B具有的性质是 (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
A.①③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
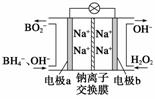 ⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。
⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。
⑵火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:
N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
 H2O2(l)===H2O(l)+
H2O2(l)===H2O(l)+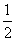 O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___
__________________________________________。
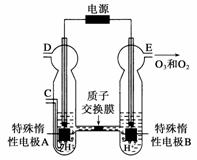
⑶O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”)。
②若C处通入O2,则A极的电极反应式为____________。
③若C处不通入O2,D、E处分别收集到15.68 L和6.72 L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为__________(忽略O3的分解)。
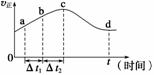 ⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)
⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间
变化的示意图如右图所示。由图可得出的正确说法是________。
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com