

加入0.1 mol MnO2粉末于50 mL一定浓度的过氧化氢溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
(1)实验时放出气体的总体积是________。
(2)放出 气体所需时间为________。
气体所需时间为________。
(3)反应放出 气体所需时间约为________。
气体所需时间约为________。
(4)A、B、C、D各点反应速率快慢的顺序为_______________。
(5)解释反应速率变化的原因:__________________________。
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为C2H5OH+3O2===2CO2+3H2O,下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为4H++O2+4e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.FeCl3溶液与Fe反应:Fe+Fe3+===2Fe2+
C.Cl2氧化Fe2+:Fe2++Cl2===Fe3++2Cl-
D.Al与稀H2SO4反应:2Al+6H+===2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D同主族,A的原子结构示意图为: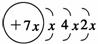 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A________,B________,C________,D________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是________。
(4)画出D的核外电子排布图________,这样排布遵循了________原理和________规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于下列各组反应,反应开始时产生H2速率最快的是( )
A.70 ℃,将0.1 mol Mg粉加入到10 mL 6 mol·L-1的HNO3溶液中
B.60 ℃,将0.1 mol Mg粉加入到10 mL 3 mol·L-1的盐酸中
C.60 ℃,将0.1 mol Fe粉加入到10 mL 3 mol·L-1的盐酸中
D.60 ℃,将0.1 mol Mg粉加入到10 mL 3 mol·L-1的H2SO4溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
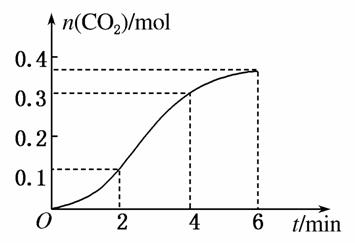
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3 mol·L-1的氨水b L,②c(OH-)=10-3 mol·L-1的氨水c L,③c(OH-)=10-3 mol·L-1的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)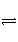
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于有机物的下列说法中正确的是( )
A.溴乙烷和乙烷都是饱和烃
B.甲烷和乙烯都可以与氯气反应
C.苯和甲苯都可被KMnO4酸性溶液氧化
D.氯乙烯可与氢气发生加成反应,溴苯不能与氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com