
下列离子方程式中,正确的是( )
|
| A. | 碳酸氢钙溶液与足量盐酸反应Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
|
| B. | 稀盐酸和碳酸钙反应 CO32﹣+2H+=CO2↑+H2O |
|
| C. | 碳酸钠溶液与醋酸反应 CO32﹣+2H+=CO2↑+H2O |
|
| D. | 大理石溶于醋酸的反应 CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O |
考点:
离子方程式的书写.
专题:
离子反应专题.
分析:
A.反应实质为碳酸氢根离子与氢离子反应生成水和二氧化碳;
B.碳酸钙不溶于水,离子反应中保留化学式;
C.醋酸为弱酸,离子反应中保留化学式;
D.反应生成醋酸钙、水和二氧化碳.
解答:
解:A.碳酸氢钙溶液与足量盐酸反应的离子反应为HCO3﹣+H+=H2O+CO2↑,故A错误;
B.稀盐酸和碳酸钙反应的离子反应为CaCO3+2H+=CO2↑+H2O+Ca2+,故B错误;
C.碳酸钠溶液与醋酸反应的离子反应为CO32﹣+2CH3COOH=CO2↑+H2O+2CH3COO﹣,故C错误;
D.大理石溶于醋酸的反应的离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O,故D正确;
故选D.
点评:
本题考查离子反应方程式的书写,注意碳酸钙、醋酸在离子反应中应保留化学式及发生的化学反应即可解答,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
反应2SO2+O22SO3达到平衡状态后,下列说法正确的是( )
A.三氧化硫的生成速率与分解速率相等
B.二氧化硫、氧气、三氧化硫的分子数之比是2:1:2
C.二氧化硫与氧气不再化合生成三氧化硫
D.降低温度,原化学平衡状态未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
对于以下反应:A(s)+3B(g)⇌2C(g)+D(g),在一定温度和容积固定的容器中,下列判断正确的是( )
|
| A. | 当容器内的压强不再变化,可以判断反应已经达到平衡 |
|
| B. | 往容器中通入稀有气体He,由于压强增大,所以反应速率增大 |
|
| C. | 往容器中加入少量A,反应速率增大 |
|
| D. | 若反应是放热反应,升高温度,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可加热)( )
|
| A. | BaCl2 | B. | NaOH | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
|
| A. | H2SO3>I﹣>Fe2+>NO | B. | I﹣>Fe2+>H2SO3>NO |
|
| C. | Fe2+>I﹣>H2SO3>NO | D. | NO>Fe2+>H2SO3>I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
现在要分离下列物质,请根据分离实例,将合适的分离方法填在后面的直线上.
(1)要除去NaCl溶液中的泥沙
(2)用CCl4提取溴水中的溴单质
(3)分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)
(4)分离汽油和水
(5)从含有少量NaCl的KNO3溶液中提取KNO3
(6)分离Fe(OH)3胶体中含有的FeCl3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
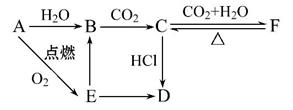
(1)写出A、B、C、D、E、F的化学式:
A. ;B. ;C. ;
D. ;E. ;F. 。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
B C: ___________________________________________________,
C: ___________________________________________________,
E B: __________________________________________________,
B: __________________________________________________,
C F: __________________________________________________,
F: __________________________________________________,
F C: __________________________________________________。
C: __________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是( )
|
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
|
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
|
| C. | 晶体中一定存在化学键 |
|
| D. | 正四面体分子中键角只能是109°28′ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com