
【题目】科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。

请回答下列问题:
(1)下列相关说法中,正确的是________(填序号)。
a.N4是N2的同分异构体
b.1 mol N4分解生成N2,形成了4 molπ键
c.白磷的沸点比N4高,是因为P-P键键能比N-N键能大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
(2)已知白磷、NH4+ 、N4H44+的空间构型均为四面体结构,参照NH4+和白磷的结构式,画出N4H44+的结构式(配位键用![]() 表示)________________;
表示)________________;
(3)在叶绿素结构示意图上标出N与Mg元素之间的配位键和共价键(配位键用![]() 表示)_______
表示)_______
(4)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。根据等电子体理论写出N3-的电子式_____________;叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是 ________________,写一种与SO42-等电子体的分子 ________________。
(5)六方相氮化硼晶体内B-N键数与硼原子数之比为_______,其结构与石墨相似却不导电,原因是_______________________________________。

【答案】b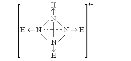
![]()
![]() +3N3-、NH3CCl4、SiCl4、CBr4、SiF4等合理答案即可3:1立方氮化硼晶体内无自由移动的电子
+3N3-、NH3CCl4、SiCl4、CBr4、SiF4等合理答案即可3:1立方氮化硼晶体内无自由移动的电子
【解析】
本题为新情景题,主要考查我们灵活运用所学基础知识,分析解答新问题的能力。
(1)由题意可知,N4与N2是由氮元素组成的两种不同的单质,二者互为同素异形体;一个N2中含有2个π键;结构相似的分子晶体,相对分子量越大,熔沸点越高;同主族从上到下,非金属性减弱,以此解答。
(2)因为N4H44+的空间构型与P4相同,即N4H44+中的四个氮原子构成正四面体结构,每个氮原子与另外三个氮原子以共价键结合,且四个氮原子分别单方面提供共用电子对与H+结合,用“→”表示。
(3)镁离子为+2价,和4个氮原子作用,形成2个共价键和两个配位键。
(4) N3-和CO2是等电子体,根据CO2的电子式写出N3-的电子式;在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,配位体:提供孤电子对的分子或离子;等电子体是具有相同的价电子数和原子数的分子或离子。
(5) 六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,该物质的层状结构中不存在自由移动的电子,以此解答。
(1) a.分子式相同结构不同的化合物互称同分异构体,N4与N2都是N元素的单质,属于同素异形体,故a错误;
b.一个N2中含有2个π键,1mol N4分解生成2molN2,形成了4mol π键,故b正确;
c.结构相似的分子晶体,相对分子量越大,熔沸点越高,白磷的相对分子量比N4大,与键能无关,故c错误;
d.同主族从上到下,非金属性减弱,则P的非金属性比N弱,白磷的化学性质比N2活泼,与共价键稳定性有关,故d错误;
故答案为:b;
(2) N4H44+中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键,则N4H44+的结构图为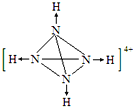 ;
;
故答案为: ;
;
(3)由叶绿素结构示意图可知,有两个氮原子提供孤对电子,镁元素提供空轨道,形成两个配位键,另外两个氮原子和镁原子形成共价键,故答案为:![]() ;
;
(4)N3-和CO2是等电子体,根据CO2的电子式写出N3-的电子式为![]() ;在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,设钴的化合价为+x,则+x+(-1)+(-2)=0,解得x=+3价,它的配体是N3-、NH3;SO42-中含有32个价电子和5个原子,其等电子体的分子可以为CCl4、SiCl4、CBr4、SiF4等;
;在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,设钴的化合价为+x,则+x+(-1)+(-2)=0,解得x=+3价,它的配体是N3-、NH3;SO42-中含有32个价电子和5个原子,其等电子体的分子可以为CCl4、SiCl4、CBr4、SiF4等;
故答案为:![]() ;+3;N3-、NH3;CCl4、SiCl4、CBr4、SiF4等;
;+3;N3-、NH3;CCl4、SiCl4、CBr4、SiF4等;
(5)六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,六方相氮化硼晶体内B-N键数与硼原子数之比为3:1,该物质的层状结构中不存在自由移动的电子,所以不导电,
故答案为:3:1;立方氮化硼晶体内无自由移动的电子。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.化学用语具有简便、确切地表达化学知识和化学科学思维的特点.下列化学用语中书写正确的是( )
A. N2的电子式:![]()
B. 次氯酸的结构式:H-O-Cl
C. CO2分子的比例模型 :![]()
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,进行可逆反应A(g)+2B(g) ![]() C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )
C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )
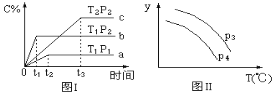
A. 正反应是放热反应
B. P1 <P2
C. 若P3<P4,y轴表示A的转化率
D. 若P3>P4,y轴表示C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法;保持污水的pH在5.0~6.0之间,利用电解过程中生成的Fe(OH)3沉淀的吸附性吸附污物而沉积下来,模拟处理装置如下。下列有关说法中错误的是
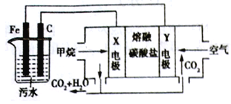
A. X电极是负极,电极反应式为:CH4-8e-+4CO32-=5CO2+2H2O
B. 铁是阳极,先失去电子生成Fe2+
C. 工作时熔融碳酸盐中的CO32-移向Y电极
D. 污水中存在反应4Fe2++10H2O+O2=4Fe(OH)3+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O],俗名莫尔盐,蓝绿色的固体,易溶于水,几乎不溶于乙醇,在 100℃~110℃时分解,对光敏感。在空气中逐渐风化及氧化。在空气中比硫酸亚铁稳定,有还原性。常用作重铬酸钾、高锰酸钾等溶液的互相标定的标准物质。一般用废铁屑经以下流程制取:

(1)检验莫尔盐固体中亚铁离子,可将样品溶于水后,滴加 K3[Fe(CN)6]溶液,反应的现象是________________。
(2)下列说法中正确的有____。
A.用 NaOH 溶液洗涤废铁屑的作用是去除废铁屑表面的油污和氧化铁杂质
B.蒸发应用小火小心加热,直到出现大量晶体停火利用余热蒸干溶剂
C.过滤后可用少量乙醇洗涤
D.检验莫尔盐固体样品中铵离子,可将样品溶于水后,再加足量 NaOH 稀溶液,将湿润的红色石蕊试纸置于试管口,若观察到试纸变蓝,表明固体中存在 NH4+,否则无 NH4+
E.检验莫尔盐固体是否氧化变质,可将样品溶于水后,滴加 KSCN 溶液,溶液变红,说明氧化变质
(3)用重铬酸钾溶液标定(滴定)莫尔盐溶液浓度,若需配制浓度为 0.01000molL-1 的 K2Cr2O7 标准溶液 250mL,应准确称取____________________g K2Cr2O7(保留 4 位有效数字,已知 M( K2Cr2O7)=294.0gmol-1).配制该标准溶液时,下列仪器中不必要用到的有__________________ .
①电子天平 ②烧杯 ③温度计 ④玻璃棒 ⑤容量瓶⑥铁架台(带铁圈) ⑦胶头滴管
滴定操作中,如果滴定前装有 K2Cr2O7 标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____(填“偏大”、“偏小”或“不变”)。
(4)向(NH4)2Fe(SO4)2 溶液中滴加一定量的 NaOH 溶液时,发生的总反应的离子方程式一定错误的是____。(填字母)
A.Fe2++2OH-===Fe(OH)2↓
B.NH4++OH-===NH3·H2O
C.Fe2++3OH-+NH4+===Fe(OH)2↓+NH3·H2O
D.Fe2++5OH-+3NH4+===Fe(OH)2↓+3NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物结构的说法错误的是( )
A.一氯乙烷有两种同分异构体B.苯分子中六个碳碳键键长完全相等
C.乙烯分子中所有原子处于同一平面内D.乙醇的核磁共振谱图中有3个特征峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式_____________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是________(填序号).

(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀有金属钌(Ru)的性质很稳定,耐腐蚀。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法错误的是
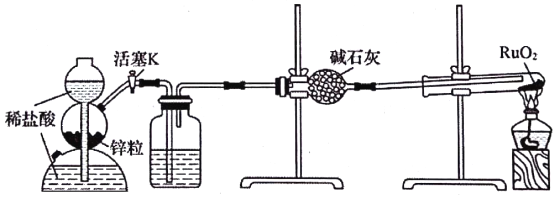
A. 加热RuO2前,应先收集气体并点燃,通过声音判断气体纯度
B. 洗气瓶中盛装的可能是NaOH溶液,用于除去挥发出来的HCl气体
C. 结束反应时,先停止加热,待试管冷却到室温后再关闭活塞K
D. 启普发生器也可用于碳酸钠晶体与稀硫酸反应制备二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+比B3+多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E与C同主族且处于C的下两个周期。试回答:
(1)A是________(写元素符号),D是________(写元素名称).
(2)B的离子结构示意图________,A的单质分子的电子式__________,C元素最高价氧化物对应的水化物的电子式________。
(3)用电子式表示H2A形成过程:____________________。
(4)写出CD的溶液中通入氯气的离子方程式:_______________
(5)比较B、C、E三种元素形成的简单离子的半径大小:(B、C、E离子用实际离子符号表示) ________ > __________ > __________ 。
(6) 比较C 、E 两元素最高价氧化物对应的水化物的碱性强弱(用化学式表示)________ > __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com