


科目:高中化学 来源: 题型:
A、N原子的最外层电子轨道表示式: | ||
B、质子数为35、中子数为45的溴原子:
| ||
C、硫离子的结构示意图: | ||
D、间二甲苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾 | |
| 体积 (mL) | 浓度 (mol?L-1) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+NH4+Cl-NO3- |
| B、Cu2+H+HCO3-Cl- |
| C、Fe3+H+Cl-SCN- |
| D、Ba2+H+NO3-Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1 452 kJ?mol-1 |
| B、CH3OH(l)+1.5O2(g)=CO2(g)+2H2O(g)△H=-725.8 kJ?mol-1 |
| C、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-725.8 kJ?mol-1 |
| D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=+1 452 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
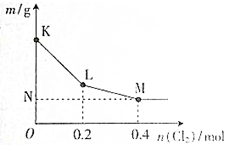 向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )
向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )| A、K→L段发生反应的离子方程式为2Br-+Cl2═2Cl-+Br2 |
| B、原溶液中,c(Na+ )=4mol?L-1 |
| C、原溶液中,c(I-)=2mol?L-1 |
| D、M点代表的固体质量为46.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com