
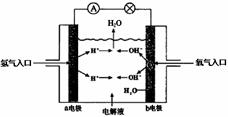
 如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式
如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
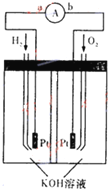 (1)在原电池中,较活泼的金属极上发生
(1)在原电池中,较活泼的金属极上发生查看答案和解析>>
科目:高中化学 来源: 题型:
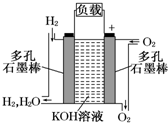
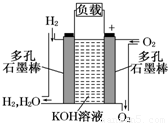
 (1)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
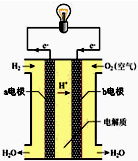 如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池.该电池的正极是
如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池.该电池的正极是查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省吉安市泰和中学高一(下)第一次月考化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com