
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
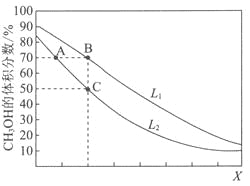
下列说法中,正确的是( )
A.X代表压强B.L1<L2
C.平衡常数:K(A)=K(B)D.在C点时,CO转化率为75%
【答案】D
【解析】
A、根据勒夏特列原理,增大压强,平衡向体积减小的方向进行,根据反应方程式,增大压强应向正反应方向移动,CH3OH的体积分数增大,故错误;
B、根据A选项分析,X代表的是温度,L代表压强,增大压强,平衡向正反应方向移动,甲醇的体积分数增大,即L1>L2,故错误;
C、化学平衡常数只受温度影响,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,即向逆反应方向移动,B的温度高于A,K(A)>K(B),故错误;
D、CO(g)+2H2(g)![]() CH3COH(g)
CH3COH(g)
起始:1 2 0
变化:x 2x x
平衡:1-x 2-2x x
甲醇的体积分数x/(1-x+2-2x+x)×100%=50%,x=0.75mol,则CO的转化率为0.75/1×100%=75%,故正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是
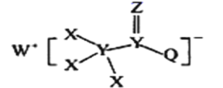
A.WX是共价化合物
B.最高价氧化物对应的水化物的酸性:Q<Y
C.原子半径:W>Z>Y
D.Z和X、Y、W、Q均形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+ Cl2↑+2H2O
MnCl2+ Cl2↑+2H2O
B.氢氧化钡溶液中加入硫酸铵:Ba2++OH-+![]() +
+![]() ===BaSO4↓+NH3·H2O
===BaSO4↓+NH3·H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+===Fe3++2H2O
D.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:![]() +Al3++2
+Al3++2![]() +2Ba2++4OH-===2BaSO4↓+Al(OH)3↓+NH3·H2O
+2Ba2++4OH-===2BaSO4↓+Al(OH)3↓+NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)关于反应H2(g)+![]() O2(g)===H2O(l),下列说法正确的是________(填字母)。
O2(g)===H2O(l),下列说法正确的是________(填字母)。
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.该反应在常温下不易被观察,因为具有较高的活化能,反应速率小
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)电渗析法淡化海水装置示意图如图所示,在电场中利用膜技术可以实现淡化海水和浓缩海水的分离。
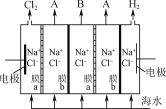
①图中膜a应选用________(填“阳离子”或“阴离子”)交换膜。
②各间隔室的排出液中,A为________(填“淡化海水”或“浓缩海水”)。
③电渗析法还可用来处理电镀废液,写出用该方法处理含AgNO3废液时所发生反应的化学反应方程式:______。
(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2 ℃)、临界压强(22.1 MPa)时的水称为超临界水。
①如果超临界水的电离度变为常温下的100倍,则此时Kw的值为____。
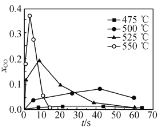
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图,其中x为以碳元素计的物质的量分数,如xCO=![]() ,t为反应时间。 CO的分布分数先增后降的原因是___。
,t为反应时间。 CO的分布分数先增后降的原因是___。
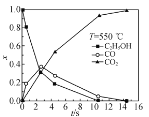
③不同温度下乙醇的超临界水氧化过程中CO的分布分数随时间变化如图所示,随着温度升高,CO分布分数峰值出现的时间提前且峰值更高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
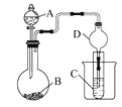
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的含硫物质在一定条件下能够相互转化,这种转化在人工条件下也能发生。
(1)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。
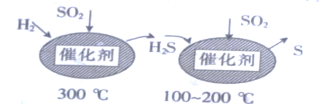
①H2S的电子式为_________________________________。
②第二步反应中SO2体现_____________性。(填“氧化”或“还原”)
③总反应的化学方程式为_________________________。
(2)利用氨水吸收烟气中的二氧化硫,涉及反应2(NH4)2SO3(aq) + O2(g) ![]() 2(NH4)2SO4(aq)。
2(NH4)2SO4(aq)。
①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,氧化速率减小的原因可能是 _______, (NH4)2SO4溶液呈酸性的原因是__________ (用离子方程式表示)。
②常温下,向(NH4)2SO3和(NH4)2SO4的混合液中滴加足量的氯化钡溶液,充分反应后测得溶液中![]() , 则Ksp(BaSO4)=__________[已知Ksp(BaSO3)= 5×10-7]
, 则Ksp(BaSO4)=__________[已知Ksp(BaSO3)= 5×10-7]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
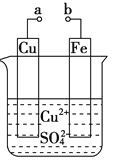
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com