
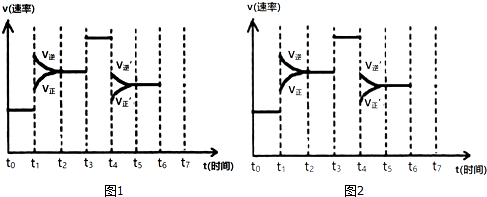
分析 (1)根据图示结合v正=v逆,判断是否处于平衡状态;
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析;
(4)合成氨反应达到平衡时,若将密闭容器体积缩小一半,则各组分浓度增加,压强增大,速率加快;
(5)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线.
解答 解:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,故答案为:ACDF;
(2)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;t3时正逆反应速率均增加,且逆反应速率等于正反应速率,改变条件应为加催化剂.
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:C;E;B;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,
故答案为:A;
(4)合成氨反应达到平衡时,若将密闭容器体积缩小一半,则各组分浓度增加,压强增大,速率加快;
A.正反应速率增加,逆反应速率增大,故错误;
B.正反应速率增大,逆反应速率增大,故错误;
C.正、逆反应速率都增大,故错误;
D.正、逆反应速率都增大,故正确.
故选D.
(5)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线为: ,故答案为:
,故答案为: .
.
点评 本题考查影响化学反应速率的因素,注意把握反应的特点及图象分析是解答的关键,明确温度、压强、催化剂对反应速率的影响即可解答,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000a%}{98x}$g/ml | B. | $\frac{x}{98a%}$g/mol | C. | $\frac{98x}{a%}$g/ml | D. | $\frac{98x}{10a}$g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
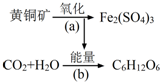 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
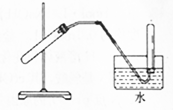
| A. | 用浓硫酸和铜制取二氧化硫 | B. | 用锌粒与稀硫酸反应制取氢气 | ||
| C. | 用氯化铵与氢氧化钙反应制取氨气 | D. | 用铜与浓硝酸反应制取二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
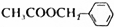 )是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
)是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
 .
. ,名称为苯甲醇.
,名称为苯甲醇.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com