
| H2SO4 |
| NaOH |
| NaOH |
| AlO | - 2 |
| H2SO4 |
|

| Al2O3 | Fe2O3 | 其他杂质 | |
| 铝土矿 | 55% | 16% | - |
| 赤泥 | 15% | 48% | 一 |
| 3.4 |
| 55% |


科目:高中化学 来源: 题型:阅读理解

| 45c |
| 56a |
| 45c |
| 56a |
查看答案和解析>>
科目:高中化学 来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省南充市高三第二次诊断性考试(理综)化学部分 题型:填空题
铝是国民经济发展的重要材料,铝在地壳中的含量约占8% ,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:
方案3 : o
o
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图16所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
|
|
Al2O3 |
Fe2O3 |
其他杂质 |
|
铝土矿 |
55% |
16% |
— |
|
赤泥 |
15% |
48% |
一 |
(1) 书写化学方程式,反应①_________,反应②________________
(2) 电解氧化铝生产铝时,阳极的电极反应式为________________。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿________t
查看答案和解析>>
科目:高中化学 来源:2012届安徽省天长市高二下学期月考化学试题 题型:填空题
铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:
方案3 :
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图所示:
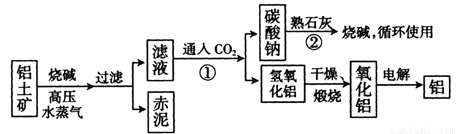
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
|
|
Al2O3 |
Fe2O3 |
其他杂质 |
|
铝土矿 |
55% |
16% |
— |
|
赤泥 |
15% |
48% |
一 |
(1) 书写化学方程式,反应①_______ ,
反应②______________ __
(2) 电解氧化铝生产铝时,阳极的电极反应式为____________ _。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿______ __t
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com