
����Ŀ����X��Y��Z��Q��T����Ԫ�أ�Xԭ�ӵ�M��p�����2��δ�ɶԵ��ӣ�Yԭ�ӵ���Χ���ӹ���Ϊ3d64s2��Zԭ�ӵ�L���Ӳ��p�ܼ�����һ�չ����Qԭ�ӵ�L���Ӳ��p�ܼ���ֻ��1�ԳɶԵ��ӣ�Tԭ�ӵ�M���Ӳ���p�����������Իش��������⣺
(1)X��Ԫ�ط���__________��Y��Ԫ�ط���________��
(2)ZԪ��ԭ�ӵĵ����Ų�ʽ_______��QԪ��ԭ�ӵĵ����Ų�ͼ__________��TԪ��ԭ�ӵĵ����Ų�ͼ_______________________________��
(3)Y�ĵ�����Q�ĵ�����ȼ�յĻ�ѧ����ʽ��_________________________��
���𰸡�Si��S Fe 1s22s22p2 ![]()
![]() 3Fe��2O2
3Fe��2O2![]() Fe3O4
Fe3O4
��������
������Ԫ��X��Y��Z��Q��TԪ��Ϊ����Ԫ�أ�Xԭ�ӵ�M��p�����2��δ�ɶԵ��ӣ���������Ų�Ϊ1s22s22p63s23p4��1s22s22p63s23p2����XΪS��SiԪ�أ�Yԭ�ӵ��������ӹ���Ϊ3d64s2����YΪFe��Zԭ�ӵ�L���Ӳ��p�ܼ�����һ���չ������������Ų�Ϊ1s22s22p2����ZΪCԪ�أ�Qԭ�ӵ�L���Ӳ��p�ܼ���ֻ��һ�ԳɶԵ��ӣ���������Ų�Ϊ1s22s22p4����QΪOԪ�أ�Tԭ�ӵ�M���Ӳ���p������������������Ų�Ϊ1s22s22p63s23p3����TΪPԪ�أ��ݴ˽��
��1���ɷ�����֪��XΪS��SiԪ�أ�YΪFe���ʴ�Ϊ��Si��S��Fe��
��2��ZΪCԪ�أ��˵����Ϊ6�������Ų�ʽΪ1s22s22p2��QΪOԪ�أ��˵����Ϊ8����ԭ�ӵĺ�������Ų�ͼΪ![]() ��TΪPԪ�أ��˵����Ϊ15����ԭ�ӵĺ�������Ų�ͼΪ
��TΪPԪ�أ��˵����Ϊ15����ԭ�ӵĺ�������Ų�ͼΪ![]() ���ʴ�Ϊ��1s22s22p2��
���ʴ�Ϊ��1s22s22p2��![]() ��
��![]() ��
��
��3��Y�ĵ�����Q�ĵ�����ȼ�������ڴ�����ȼ��������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe��2O2![]() Fe3O4���ʴ�Ϊ��3Fe��2O2
Fe3O4���ʴ�Ϊ��3Fe��2O2![]() Fe3O4��
Fe3O4��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��3A(g)![]() 3B(��)+C(��)��H��0�������¶����ߣ�����ƽ����Է��������б�С���ƣ��������ж���ȷ����( )
3B(��)+C(��)��H��0�������¶����ߣ�����ƽ����Է��������б�С���ƣ��������ж���ȷ����( )
A. B��C���ܶ��ǹ��� B. ��CΪ���壬��Bһ��������
C. B��Cһ���������� D. B��C�����ܶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������(����)
A.  ��ʾH2��O2������Ӧ�����е������仯����H2O(g)�TH2(g)+1/2O2(g)�ġ�H����241.8 kJmol��1
��ʾH2��O2������Ӧ�����е������仯����H2O(g)�TH2(g)+1/2O2(g)�ġ�H����241.8 kJmol��1
B.  ��ʾA��B�����ʵ��ܽ�����¶ȱ仯�������T1 KʱA��B�ı�����Һ�ֱ�������T2 Kʱ�����ʵ���������B��A
��ʾA��B�����ʵ��ܽ�����¶ȱ仯�������T1 KʱA��B�ı�����Һ�ֱ�������T2 Kʱ�����ʵ���������B��A
C.  ��ʾþ��������������������������ʱ��ı仯��0��t1��Ӧ���ʼӿ��ԭ������Ǹ÷�ӦΪ���ȷ�Ӧ
��ʾþ��������������������������ʱ��ı仯��0��t1��Ӧ���ʼӿ��ԭ������Ǹ÷�ӦΪ���ȷ�Ӧ
D.  ��ʾ������ϡ��pH��ͬ�������������ʱ��ҺpH�����ˮ����Ĺ�ϵ���������Ϊ���ᣬ��a��Kw����ֵ��b��Ĵ�
��ʾ������ϡ��pH��ͬ�������������ʱ��ҺpH�����ˮ����Ĺ�ϵ���������Ϊ���ᣬ��a��Kw����ֵ��b��Ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ŵͪ���˹��ϳɵĿ���ҩ�����м���G�ĺϳ�·�����£�

(1)G�еĺ���������Ϊ_____��_____(������)��
(2)��C��D�ķ�Ӧ������_____��
(3)������X(����ʽΪC3H7N)�Ľṹ��ʽΪ_____��
(4)B���Ҵ���Ӧ�IJ���ΪH(C8H6FCl2NO2)��д����������������H��һ��ͬ���칹��Ľṹ��ʽ��_____��
����һ�����������
��������4�ֲ�ͬ��ѧ�������⣬�ҷ����к���һ��������
(5)��������֪ʶ����������Ϣ��д����![]() ��ClMgCH(COOC2H5)2Ϊԭ���Ʊ�
��ClMgCH(COOC2H5)2Ϊԭ���Ʊ�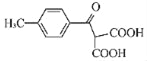 �ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������)_____��
�ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������)_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������NaBH4��ZnCl2�������¿�ת��Ϊ��������NaBH4ת��ΪH3BO3��

(1)Zn2+��̬��������Ų�ʽΪ_____��
(2)���״�(![]() )��̼ԭ�ӵ��ӻ��������Ϊ_____��
)��̼ԭ�ӵ��ӻ��������Ϊ_____��
(3)1mol���������(![]() )�����к�����������ĿΪ_____mol��
)�����к�����������ĿΪ_____mol��
(4)��BH4����Ϊ�ȵ������������Ϊ_____(�ѧʽ)��BH4�����ӵĿռ乹��Ϊ(����������)_____��
(5)������һ�ֲ�״�ṹ��ɫ���壬���ڵ�H3BO3����ͨ���������(��ͼ��ʾ)��1molH3BO3��������_____mol�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����շ�ӦBr+H2 ![]() HBr+H�ķ�Ӧ����ʾ��ͼ��������������ȷ����
HBr+H�ķ�Ӧ����ʾ��ͼ��������������ȷ����

A. �÷�Ӧ�ķ�Ӧ�ȡ�H=E2��E1
B. ����ӦΪ���ȷ�Ӧ
C. ���ȷ�Ӧһ��Ҫ���Ⱥ���ܷ���
D. �����¶ȿ���������Ӧ���ʣ������淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(NOx)�Ǵ�����Ҫ��Ⱦ���Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
��1��N2O�ֳ�Ц�����������������ã�N2O��һ�������¿ɷֽ�ΪN2��O2���ش��������⣺
��֪����N2(g)+O2(g)=2NO(g) ��H1=+180.5kJmol-1
��2NO(g)+O2(g)=2NO2(g) ��H2=-114.14kJmol-1
��3NO(g)=N2O(g)+NO2(g) ��H3=-115.52kJmol-1
��Ӧ2N2O(g)=2N2(g)+O2(g) ��H=_______ kJmol-1
��2������β���е�NO��CO���ڴ�����������������Ⱦ���������ȥ�����ܱ������г���10molCO��8molNO������Ӧ,���ƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ

����֪T2>T1����Ӧ2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g)����H___0���>����=����<����
2N2(g)+2CO2(g)����H___0���>����=����<����
�ڸ÷�Ӧ�ﵽƽ���Ϊͬʱ��߷�Ӧ���ʺ�NO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____(����ĸ���)
a�����ø�Ч���� b����С��������� c������CO��Ũ�� d�������¶�
��ѹǿΪ10MPa���¶�ΪT1�£�����Ӧ���е�20min�ﵽƽ��״̬����ʱ���������Ϊ4L������N2��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��N2)=____�����¶����÷�ѹ��ʾ��ƽ�ⳣ��Kp= ___MPa-1(��ѹ=��ѹ�����ʵ�������)��
����D�㣬�Է�Ӧ�������µ�ͬʱ�����������ϵѹǿ��С�����´ﵽ��ƽ��״̬������ͼ��A~G����____�㡣
��3�������������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2����һ��������O2��NH3��NOx�Ļ����������ͨ��װ�д���M�ķ�Ӧ���з�Ӧ����Ӧ��ͬʱ�䣬NOx��ȥ�����淴Ӧ�¶ȵı仯������ͼ��ʾ��

����50��~150�淶Χ�����¶����ߣ�NOx��ȥ����Ѹ��������ԭ����____��
�ڵ���Ӧ�¶ȸ���380��ʱ��NOx��ȥ����Ѹ���½���ԭ�������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����պ�����ҵ���ٷ�չ����ͭ�Ͻ�㷺���ں��չ�ҵ������ͭ�Ͻ��и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�

ע��A1(OH)3��Cu(OH)2�ֽ��¶ȷֱ�Ϊ450���80��
(1)�ڵ�⾫����ʱ����������Ϊ___________��
(2)�ӿ�����(��������)����ϡH2SO4���ʵĴ�ʩΪ___________(д������)��
(3)����A��ϡHNO3��Ӧ�������������ڿ�����Ѹ�ٱ�Ϊ����ɫ������A��ϡHNO3��Ӧ�����ӷ���ʽΪ______________________��
(4)���˲�����Ҫ�IJ����������ձ����___________��
(5)��������B�����Ϊ___________�������ɹ���B�Ĺ����У������NaOH�ļ���������NaOH�����������������ķ�Ӧ�����ӷ���ʽΪ___________��
(6)���ս�ͨ����������ԭ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���黯��(GaAs)�������İ뵼����ϣ������������ͼ�������̫���ܵ�صIJ��ϵȡ�

�Իش���������
(1)д����̬Asԭ�ӵĺ�������Ų�ʽ_______��
(2)����Ԫ�������ɣ�ԭ�Ӱ뾶Ga _____As(������������<����ͬ)����һ������Ga _____As
(3)AsCl5���ӵ����幹��Ϊ___________������As���ӻ��������Ϊ_______��
(4)GaF3���۵����1000�棬GaCl3���۵�Ϊ79�棬��ԭ����________��
(5)GaAs���۵�Ϊ1238�棬�侧���ṹ��ͼ��ʾ���þ��������Ϊ_______����As��_____�����ϡ���֪�����ӵ�����ΪNA����������![]() ��lnm���˾�����ܶ�Ϊ_____ g��cm��3(д������ʽ)��
��lnm���˾�����ܶ�Ϊ_____ g��cm��3(д������ʽ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com