
(8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验步骤 | 实验结论 |
①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是________、________。
(2)②中反应的化学方程式为________________。
③中反应的离子方程式为__________________。
(3)CCl4在实验中所起的作用是________。
(4)该同学的实验设计不足之处是___________________,改进的办法是____________。
科目:高中化学 来源:2014-2015福建省四地六校高一下学期第一次联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.11.2 LO2和O3组成的混合气体含有原子数为NA
B.常温常压下,1.7 g NH3含有的电子数目为 NA
C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA
D.标准状况下,22.4 L NO2与足量的H2O充分反应后转移电子数为 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:填空题
(6分)现有0.1 mol·L-1的Na2SO4和0.1 mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2 mol·L-1的 Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
(1)当加入50 mLBa(OH)2溶液时,所得溶液中的溶质是 ,其物质的量浓度为 mol·L-1。
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液中溶质为 ,则该溶质物质的量浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:选择题
下列各组物质中,括号内为杂质,其中除杂方法不正确的是
A.Na2CO3固体(NaHCO3) 加热 B.I2(砂子) 加热
C.Na2O2(Na2O) 氧气中加热 D.Cl2(HCl) 通过NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:选择题
合乎实际并用于工业生产的是
A、金属钠在氯气中燃烧制氯化钠 B、氢气和氯气混合经光照制氯化氢
C、氯气通入澄清石灰水中制漂白粉 D、高温分解石灰石制生石灰
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与强酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.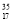 Cl与
Cl与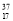 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
下列解释事实的方程式正确的是
A.在空气中切开金属钠,光亮表面变暗:2Na+O2===Na2O2
B.向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3+ + 3OH-===Al(OH)3↓
C.将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)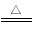 Fe2O3+3H2
Fe2O3+3H2
D.电解饱和氯化钠溶液,产生气体:2NaCl+2H2O  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三第二学期期末练习理综化学试卷(解析版) 题型:简答题
(14分)某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
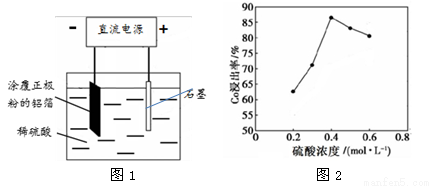
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2 + 4H+ + e- === Li+ + Co2+ + 2H2O 、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4) > 0.4 mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
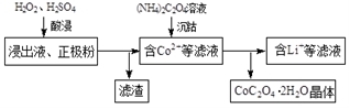
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
a.c (NH4+)> c(C2O42-)>c (H+)>c (OH-)
b.c (H+) +c (NH4+) =c (OH-) + c(HC2O4-)+c(C2O42-)
c.c (NH4+)+ c (NH3H2O ) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2(M = 98 g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O (M = 183 g·mol-1)的质量不高于 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com